Điều trị Insulin trên bệnh nhân Đái tháo đường type 2
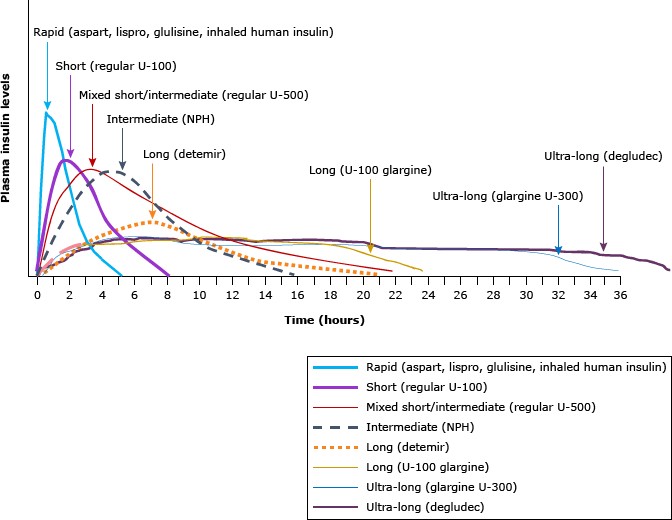
Các loại insulin và thời gian tác động – source: Pharmacokinetic profile of currently available single insulin products – Uptodate
THÔNG TIN MỚI
Nghiên cứu về sử dụng liệu pháp insulin nền mỗi tuần một lần (insulin icodec) để điều trị bệnh nhân ĐTĐ-2 (Tháng 7 năm 2023)
Trong một nghiên cứu trên 588 người trưởng thành mắc ĐTĐ-2 (A1C trung bình khoảng 8,6%), trước đây chưa từng sử dụng insulin, những người tham gia được chỉ định ngẫu nhiên vào nhóm tiêm insulin nền bằng chế phẩm insulin icodec mỗi tuần một lần , nhóm
còn lại sẽ tiêm insulin degludec hàng ngày. Sau 26 tuần, điều trị bằng icodec dẫn đến giảm nhẹ A1C (chênh lệch điều trị ước tính -0,2%). Số đợt biến cố hạ đường huyết mức độ 2 (glucose <54 mg/dL [3 mmol/L]) cao hơn rõ rệt ở nhóm dùng icodec (53 so với 23 ở nhóm degludec trong 31 tuần). Những phát hiện
tương tự đã được báo cáo trong một nghiên cứu khác kéo dài 78 tuần so sánh insulin icodec tiêm hàng tuần với insulin glargine U- 100 tiêm hàng ngày [2]. Icodec cải thiện A1C ít
nhưng lại làm tăng tỷ lệ hạ đường huyết độ 2. Cần có những nghiên cứu sâu hơn để xác định vai trò tiềm năng của insulin này trong thực hành lâm sàng.
GIỚI THIỆU
ĐTĐ- 2 là loại tiểu đường phổ biến nhất ở trưởng thành. Nó được đặc trưng bởi tình
trạng tăng đường huyết và mức độ khác nhau của tình trạng thiếu hụt và đề kháng insulin.
Tần suất bệnh tăng lên rõ rệt tỷ lệ thuận với cân nặng.
Điều trị ĐTĐ-2 bao gồm giáo dục, đánh giá các biến chứng vi mạch và mạch máu lớn, đạt
được đường huyết mục tiêu, điều trị các yếu tố nguy cơ tim mạch và tránh các thuốc có thể làm nặng thêm các bất thường về chuyển hóa glucose hoặc lipid sẵn có. Giảm cân, ăn kiêng và dùng thuốc uống ban đầu là các biện pháp được sử dụng để cải thiện việc kiểm soát
đường huyết. Theo thời gian, phần lớn bệnh nhân tiểu đường tuýp 2 sẽ cần các liệu pháp điều trị bổ sung để duy trì mục tiêu đường huyết. Các lựa chọn điều trị bổ sung cho những bệnh nhân này bao gồm thêm thuốc uống thứ hai hoặc thứ ba hoặc thuốc tiêm, chẳng hạn như GLP-1 hoặc insulin, hoặc chuyển sang dùng insulin hoàn toàn.
NHỮNG NGUYÊN LÝ CHUNG
INSULIN – Trên bệnh nhân ĐTĐ-2, insulin chủ yếu được sử dụng theo 3 cách sau:
- Là chế phẩm insulin nền có thời gian tác dụng từ trung bình đến kéo dài (ví dụ như [NPH], detemir, glargine hoặc degludec tác dụng rất dài) để ức chế sản xuất glucose ở gan và duy trì mức glucose mục tiêu trong tình trạng đói)
- Là insulin liều bolus trước bữa ăn với thời gian tác dụng ngắn (regular) hoặc tác dụng rất nhanh (ví dụ: lispro, aspart, glulisine) để đáp ứng các yêu cầu bổ sung sau khi thức ăn được hấp thụ.
- Là sự kết hợp trộn sẵn của các chế phẩm insulin tác dụng trung gian và tác dụng ngắn hoặc tác dụng rất nhanh
Thời gian khởi phát, thời gian bán hủy, đỉnh hiệu quả và thời gian tác dụng gần đúng của các loại insulin được sử dụng phổ biến nhất trên thị trường hiện nay được trình bày trong bảng (bảng 1) và chi tiết hơn ở những bài dịch khác. Có sự khác biệt đáng kể giữa các bệnh nhân về thời gian khởi phát và thời gian tác dụng của insulin tùy thuộc đến liều lượng tiêm, vị trí tiêm, kỹ thuật tiêm và nhiều yếu tố khác; do đó, insulin phải được điều chỉnh dựa trên việc cá nhân hóa.
Chế phẩm thay thế insulin một cách sinh lý
Insulin được tiết ra trong cơ thể theo nhịp sinh học; xảy ra trong điều kiện cơ bản (không bị kích thích) và để đáp ứng với bữa ăn . Sự tiết insulin nền chiếm khoảng 50% lượng insulin sản xuất trong 24 giờ, phần còn lại được tạo ra bởi sự thay đổi trong bữa ăn (giờ ăn).
Thuật ngữ “liệu pháp insulin chuyên sâu” đã được sử dụng để mô tả các chế độ điều trị phức tạp bao gồm cùng lúc sử dụng insulin nền (được tiêm từ một đến hai mũi mỗi ngày với chế phẩm insulin có tác dụng trung gian
hoặc tác dụng kéo dài) và tiêm chồng theo các insulin tác dụng ngắn hoặc tác dụng nhanh ba hoặc nhiều hơn ,mỗi ngày trước bữa ăn để hạn chế sự dao động đường huyết sau ăn.
Mặc dù liệu pháp insulin chuyên sâu là chế độ thường dành cho bệnh nhân ĐTĐ-1, nhưng nó cũng có thể được sử dụng cho bệnh nhân ĐTĐ- 2, đặc biệt đối với những bệnh nhân đã phải dùng insulin liều cao và những người có tình trạng thiếu insulin nặng.
Nhược điểm của liệu pháp insulin – Những nhược điểm chính liên quan đến liệu pháp
insulin ở bệnh ĐTĐ-2 là tăng cân và hạ đường huyết, mặc dù dữ liệu cho thấy những tác dụng phụ này xảy ra không phổ biến hoặc nếu có xẩy ra thì cũng không nghiêm trọng nếu bệnh nhân chỉ sự dụng riêng lẻ một mình insulin nền. Tuy nhiên, những tác dụng phụ này cần
được đánh giá ghi nhận mỗi lần khám ở những
bệnh nhân dùng insulin và cần nhấn mạnh mục tiêu giảm cân hoặc duy trì cân nặng cho bệnh nhân. Mục tiêu đường huyết có thể cần phải được nới lỏng để giảm nguy cơ hạ đường huyết và/hoặc tăng cân liên quan đến sử dụng insulin quá mức.
Theo dõi đường huyết
- Glycated hemoglobin (A1C) – A1C là xét nghiệm lâm sàng được sử dụng rộng rãi nhất để theo dõi bệnh nhân ĐTĐ-2. Mức A1C mục tiêu ở bệnh nhân đái tháo đường týp 2 dùng insulin nên
được điều chỉnh theo từng cá nhân, sao cho cân bằng giữa việc giảm các biến chứng vi mạch với nguy cơ hạ đường huyết và tăng cân liên quan đến insulin. Mục tiêu điều trị hợp lý cho hầu hết bệnh nhân có thể là giá trị A1C ≤7,0% . Mục tiêu A1C nên được đặt cao hơn một chút đối với bệnh nhân lớn tuổi, bệnh nhân có nhiều bệnh nền kèm theo và những người có tuổi thọ hạn chế.
- Theo dõi glucose máu – Đo nồng độ glucose tức thời (theo dõi đường huyết [bằng đường huyết mao mạch và xét nghiệm đường huyết tĩnh mạch] hay biện pháp theo dõi glucose liên tục theo thời gian thực) được sử dụng để kiểm soát đường huyết theo từng giờ và từng ngày, để hỗ trợ lựa chọn liều lượng insulin. Nói chung, với người trưởng thành trẻ hoặc trung niên khỏe mạnh để đạt được mục tiêu A1C ≤7,0% thì
đường huyết đói sẽ cần duy trì từ 80 đến 130 mg/dL (4,4 đến 7,2 mmol/L) và đường huyết sau bữa ăn (90 đến 120 phút sau bữa ăn) sẽ cần duy trì dưới 180 mg/dL (10 mmol/L) là các mục tiêu cần đạt. Ở những bệnh nhân lớn tuổi, những người mắc bệnh thận mãn tính hoặc những người có các yếu tố nguy cơ của hạ đường huyết, thì nên đặt mục tiêu A1C cao hơn, cũng như mục tiêu
đường huyết đói cao hơn (ví dụ: 100 – 150 mg/dL [5 đến 8,3 mmol/ L]) .
- Tác dụng trên tim mạch – So với các thuốc uống và không phụ thuộc vào
mức độ đường huyết đạt được, insulin dường như không ngăn ngừa hoặc làm tăng các biến cố bất lợi về tim mạch.
Bổ sung insulin
- Thuốc uống sử dụng với glargine so với chỉ sử dụng thuốc uống – Tiêm Glargine dường như không làm giảm hoặc tăng biến cố tim mạch so với thuốc uống trên quần thể bệnh nhân có nguy cơ mắc bệnh tim mạch (CVD)ở mức tương đối cao, như minh họa trong kết quả của thử nghiệm lâm sàng (ORIGIN), hoặc trên quần thể bệnh nhân có nguy cơ mắc bệnh tim mạch mức độ thấp, như thể hiện trong thử nghiệm lâm sàng (GRADE).
- Trong thử nghiệm ORIGIN, hơn
12.500 bệnh nhân có các yếu tố nguy cơ tim mạch kèm với ĐTĐ- 2 hoặc đã có tiền tiểu đường
được phân ngẫu nhiên vào nhóm sử dụng glargine buổi tối nhóm còn lại sẽ điều trị theo tiêu chuẩn ban đầu. Khoảng 60% bệnh nhân mắc ĐTĐ trước đó đang sử dụng thuốc hạ đường huyết đường uống (chủ yếu là metformin hoặc sulfonylurea). Glargine được chuẩn liều để đạt mức đường huyết đói <95 mg/dL (5,3 mmol/L). Sau thời gian theo dõi
trung bình là 6 năm, mức đường huyết đói trung bình đạt được lần lượt ở 2 nhóm là 94 và 123
mg/dL (5,2 và 6,8 mmol/L).
Tỷ lệ xảy ra biến cố tim mạch
tương tự nhau ở nhóm glargine và nhóm điều trị tiêu chuẩn (lần lượt là 2,94 và 2,85 trên 100 người-năm). Chỉ 11% bệnh nhân trong nhóm trị liệu tiêu chuẩn
được nhận insulin. Giá trị A1C
tương tự nhau ở 2 nhóm lúc bắt đầu nghiên cứu (6,4%) và khi kết thúc nghiên cứu (6,2 và 6,5%).
Khoảng 60% bệnh nhân ở cả hai nhóm được điều trị bằng statin và
75% điều trị bằng thuốc ức chế men chuyển angiotensin (ACE) hoặc thuốc ức chế thụ thể angiotensin II (ARB).
o Trong thử nghiệm GRADE, 5047 bệnh nhân mắc ĐTĐ-2 và có ước đoán mắc bệnh tim mạch thấp đang dùng metformin với liều metformin tối đa ,được phân ngẫu nhiên vào một trong bốn loại thuốc hạ đường huyết thứ hai .Người ta thấy rằng điều trị bằng glargine, sitagliptin hoặc glimepiride dẫn đến tỷ lệ mắc các biến cố tim mạch nặng tương đương (lần lượt là 5,2, 5,5 và 4,7%) và nhập viện vì suy tim (lần lượt là 2,1, 2,4 và 2,4%)
trong 5 năm theo dõi. Điều quan trọng là tính an toàn trên tim mạch của sitagliptin đã được minh chứng trong một thử nghiệm lớn về kết cục tim mạch.
So sánh các loại insulin hiện hành
- Insulin degludec so với insulin glargine – Trong một nghiên cứu kéo dài hai năm, người ta quan sát thấy các biến cố tim mạch tương tự nhau ở những bệnh nhân được chỉ định ngẫu nhiên dùng insulin degludec hoặc glargine .Nghiên cứu này gồm 7637 bệnh nhân mắc bệnh ĐTĐ-2 (A1C trung bình 8,4%) và có nguy cơ cao mắc bệnh tim mạch
được chỉ định ngẫu nhiên dùng insulin degludec hoặc glargine một lần mỗi ngày. Lúc bắt đầu nghiên cứu, ghi nhận có khoảng 60% bệnh nhân đang được điều trị bằng metformin, 29% bằng sulfonylurea và 84% bằng insulin. Kết quả tổng hợp chính (tử vong do nguyên nhân tim mạch, nhồi máu cơ tim không tử vong hoặc đột quỵ không tử vong) xảy ra ở 8,5% và 9,3% bệnh nhân dùng degludec và glargine. Việc kiểm soát
đường huyết tương tự nhau trong suốt nghiên cứu; tỷ lệ hạ đường huyết nghiêm trọng và về đêm thấp hơn ở
những bệnh nhân dùng degludec, mặc dù tỷ lệ hạ đường huyết tuyệt đối là rất thấp ở cả hai nhóm điều trị (ví dụ, hạ
đường huyết nghiêm trọng xảy ra ở 4,9 so với 6,6% số người trong vòng hai năm). Mục tiêu điều chỉnh liều insulin trong nghiên cứu này là đường huyết lúc đói từ 71 đến 90 mg/dL (4 đến 5 mmol/L), với tùy chọn nâng mục tiêu cao hơn lên mức 90 đến 126 mg/dL (5 đến 7 mmol/L) nếu bệnh nhân lớn tuổi hoặc theo quyết định của nghiên cứu viên.
- Insulin nền so với insulin bữa ăn – Loại insulin (nền hoặc bữa ăn) dường như không ảnh hưởng đến kết cục tim mạch, như được quan sát thấy trong nghiên cứu HEART2D, là nghiên cứu được thiết kế để đánh giá tác động của insulin bữa ăn (lispro) hoặc insulin nền (NPH hai lần mỗi ngày hoặc insulin glargine một lần mỗi ngày) tác động như thế nào trên kết quả tim mạch ở 1115 bệnh nhân sau nhồi máu cơ tim. Lúc bắt đầu nghiên cứu, 50% bệnh nhân đang dùng metformin, sulfonylurea hoặc cả hai, trong khi những bệnh nhân còn lại đang điều trị bằng insulin đơn trị. Với thời gian theo dõi trung bình là 2,7 năm, nghiên cứu đã bị dừng sớm do thiếu sự khác biệt giữa các nhóm điều trị. Không có sự khác biệt giữa nhóm sử dụng insulin nền và insulin bữa ăn về thời gian xảy ra biến cố tim mạch tiếp theo (tử vong do tim mạch, nhồi máu cơ tim không tử vong, đột quỵ không tử vong, tái thông mạch vành hoặc nhập viện vì hội chứng vành cấp).
CHỈ ĐỊNH ĐIỀU TRỊ INSULIN
Điều trị ban đầu
Mặc dù chúng tôi đề nghị can thiệp thay đổi lối sống (ăn kiêng, giảm cân, tập thể dục) và
metformin (trong trường hợp không có chống chỉ định) để điều trị ban đầu cho bệnh nhân ĐTĐ-2, nhưng một số bệnh nhân có thể sử
dụng insulin ngay từ đầu. Các chỉ định như sau:
- Tăng đường huyết mức độ nặng tại thời điểm thăm khám
- Đối với những bệnh nhân có triệu chứng (ví dụ như sụt cân, khát nhiều, đa niệu) hoặc tăng đường huyết nặng kèm keton niệu, insulin được chỉ định để điều trị ban đầu.
- Đối với những bệnh nhân có biểu hiện tăng đường huyết nặng (đường huyết đói >250 mg/dL
[13,9 mmol/L], đường ngẫu nhiên
>300 mg/dL [16,7 mmol/L], A1C
>9% [74,9 đến 85,8 mmol/mol]) nhưng không có keton niệu hoặc sụt cân không rõ nguyên nhân, những người không giống ĐTĐ- 1, insulin (hoặc [GLP-1] ) là một lựa chọn, sử dụng cùng với metformin, nếu không có chống chỉ định.
- Trường hợp khó phân biệt được ĐTĐ type 1 hay type 2
Những bệnh nhân ban đầu được cho là mắc ĐTĐ-2 thực tế có thể mắc ĐTĐ-1. Mặc dù tỷ lệ mắc ĐTĐ-1 cao nhất xảy ra vào khoảng thời gian dậy thì, nhưng khoảng 42% trường hợp xuất hiện sau 30 tuổi.
Có một số đặc điểm lâm sàng, nếu xuất hiện ở mọi lứa tuổi, gợi ý chẩn đoán ĐTĐ-1. Chúng bao gồm tụt cân gần đây rõ rệt và không giải thích được, tiền sử ngắn với các triệu chứng rõ rệt (đa niệu, khát nhiều) và xuất hiện keton niệu mức độ trung bình hoặc nhiều hơn.
Tiền sử cá nhân hoặc gia đình mắc các bệnh tự miễn (ví dụ như suy giáp hoặc cường giáp, bệnh celiac) mà không có tiền sử gia đình mắc bệnh ĐTĐ- 2, đặc biệt ở bệnh nhân không có tiền sử thừa cân, cũng gợi ý đến ĐTĐ-1. Nhiễm toan đái tháo đường ở lần khám đầu tiên, đặc biệt nếu nặng, gợi ý rằng bệnh nhân mắc ĐTĐ-1 và sẽ cần điều trị bằng
insulin suốt đời, mặc dù nói vậy nhưng cũng sẽ có những trường hợp ngoại lệ. Một số người mắc ĐTĐ-1 khởi phát có thể không thể phân biệt được về mặt lâm sàng với bệnh nhân ĐTĐ- 2 nhưng sẽ dần dần tiến đến phụ thuộc insulin. Điều này đôi khi được gọi là “bệnh tiểu đường tự miễn tiềm ẩn ở người trưởng thành” (LADA). LADA có thể được phân biệt với ĐTĐ-2 bằng sự hiện diện của các tự kháng thể tuyến tụy, chẳng hạn như kháng thể decarboxylase axit glutamic (GAD) hoặc tyrosine phosphatase (kháng nguyên đảo-2 [IA2]). Những người này có thể đáp ứng kém với điều trị bằng thuốc hạ đường huyết uống và việc sử dụng sulfonylurea như thuốc điều trị ban đầu có thể gây ra sự phụ thuộc insulin sớm hơn . Chiến lược điều trị ban đầu tốt nhất cho LADA vẫn chưa rõ ràng. Cần có các nghiên cứu để xác định liệu điều trị sớm bằng insulin hay sử dụng liệu pháp điều hòa miễn dịch có thể ngăn ngừa sự tiến triển của bệnh hay không.
- Giảm chức năng tụy
- Các trường hợp khác
Điều trị từ đầu bằng insulin tích cực trong một thời gian ngắn (2 đến 4 tuần) có thể có lợi ở bệnh nhân ĐTĐ-2 và thi thoảng tạo ra sự thuyên giảm bệnh có thể kéo dài một năm hoặc hơn .Thông qua việc đưa mức đường huyết về gần như bình thường bằng liệu pháp insulin tích cực, cả sự tiết insulin nội sinh và độ nhạy insulin trong cơ thể đều được cải thiện. Sự cải thiện bài tiết insulin có lẽ đạt được là do loại bỏ các tác động có hại của việc tăng đường huyết lên chức năng bài tiết tế bào beta, và ở một số bệnh nhân, nó dẫn đến việc kiểm soát
đường huyết tốt hơn mà sau đó mức đường huyết này có thể được duy trì bằng chế độ ăn kiêng và tập thể dục trong nhiều tháng hoặc thậm chí nhiều năm sau đó nữa.
Điều này đã được quan sát thấy trong một nghiên cứu lâm sàng ngẫu nhiên về
liệu pháp insulin tăng cường ngắn hạn (từ 2 đến 5 tuần) so với thuốc uống (gliclazide và/hoặc metformin) ở 410 bệnh nhân Trung Quốc mắc ĐTĐ-2 mới được chẩn đoán (đường huyết đói trung bình là 202 mg/dL [11,2] mmol/L]) .
Insulin và thuốc uống được chỉnh liều để đạt mức đường huyết lúc đói <110 mg/dL (6,1 mmol/L). Việc điều trị đã
được ngừng lại hai tuần sau khi đạt
được mức đường huyết mục tiêu. Các bệnh nhân được hướng dẫn tiếp tục chế độ ăn kiêng và tập thể dục đồng thời
được theo dõi chặt chẽ tình trạng tái phát tăng đường huyết (đường huyết lúc đói >126 mg/dL [7 mmol/L] hoặc đường huyết sau bữa ăn >180 mg/dL [10 mmol/L]).
Ghi nhận thấy tỷ lệ lớn bệnh nhân dùng insulin đạt được mục tiêu đường huyết trong thời gian ngắn hơn so với bệnh nhân dùng thuốc đường uống (trên 90% trong vòng 4 đến 5,6 ngày so với 84% trong 9,3 ngày nếu dùng đường uống). Tỷ lệ thuyên giảm sau một năm ở nhóm insulin (bơm insulin hoặc tiêm nhiều lần mỗi ngày) cao hơn ở nhóm uống thuốc (51 và 45 so với 27%). Bệnh nhân thuyên giảm có mức đường huyết đói ban đầu và A1C thấp hơn, đồng thời họ đạt được đường huyết mục tiêu nhanh hơn so với những người bị tăng đường huyết tái phát.
Tuy nhiên, chiến lược điều trị insulin tích cực ban đầu, ngắn hạn chưa được sử dụng rộng rãi, có thể do sự phức tạp của việc áp dụng liệu pháp này, sự miễn cưỡng của bệnh nhân và thậm chí là sự miễn cưỡng của nhà cung cấp insulin (đưa ra những thách thức khi bắt đầu sử dụng insulin nền ở bệnh nhân mắc ĐTĐ lâu năm).
Tăng đường huyết kéo dài trên các bệnh nhân đã dùng thuốc uống
Thuốc uống trở nên kém hiệu quả hơn khi chức năng tế bào beta tụy đã suy giảm. Các lựa chọn điều trị cho bệnh nhân tăng đường
huyết kéo dài bằng can thiệp lối sống và metformin là thêm thuốc uống hoặc thuốc tiêm, ví dụ như insulin, hoặc chuyển hẳng sang dùng insulin. Đối với nhiều bệnh nhân, chúng tôi thích dùng insulin hoặc GLP-1 (nếu bệnh nhân không bị dị hóa) làm thuốc bổ sung.
Nghiên cứu GRADE cho thấy việc sử dụng sớm insulin nền bổ sung vào metformin sẽ làm giảm lượng glucose lâu dài hơn (5 năm) so với thuốc sulfonylurea hoặc dipeptidyl peptidase 4 (DPP-4), với ít tác dụng phụ. Tỷ lệ hạ đường huyết nghiêm trọng ở nhóm điều trị bằng insulin (1,3%) thấp hơn so với điều trị bằng sulfonylurea (2,2%) trong 5 năm trong thử nghiệm GRADE. Ngoài ra, insulin có tỷ lệ ngừng thuốc theo yêu cầu của người tham gia thấp nhất (tức là không ngừng thuốc theo quy định; khoảng 14% ở nhóm glargine, 23% ở nhóm glimepiride và liraglutide và 19% ở nhóm sitagliptin). Cách tiếp cận để lựa chọn loại thuốc thứ hai, đặc biệt khi có bệnh lý tim mạch hoặc thận đi kèm, sẽ được trình bày trong một bài dịch khác.
DESIGNING AN INSULIN REGIMEN
Sự khác biệt về mức đường huyết đạt được
,giữa các chế phẩm insulin khác nhau, giả sử rằng chúng đã được chỉnh liệu thích hợp, là rất ít. Tuy nhiên, insulin nền thường được chỉnh liều dưới mức tối ưu trong thực hành lâm sàng. Phần lớn các nghiên cứu đánh giá tác dụng của insulin đối với mức đường huyết nhưng không cung cấp thông tin về tác dụng của các chế phẩm insulin khác nhau đối với các biến chứng mạch máu nhỏ hoặc mạch máu lớn cũng như tử vong.
Khởi trị insulin
Đối với những bệnh nhân đang bắt đầu sử dụng insulin (kèm thuốc uống, thay cho thuốc uống hoặc điều trị ban đầu), chúng tôi khuyên bạn nên bắt đầu bằng insulin nền, thay vì các chế phẩm insulin dùng liên quan đến bữa ăn.
Insulin nền sẽ cải thiện mức đường huyết đói và ban đêm , trong khi insulin tiêm nhanh vào bữa ăn (trước bữa ăn) sẽ làm giảm sự dao động glucose sau bữa ăn. Liệu chiến lược điều
trị insulin nền hay theo bữa ăn, chiến lược nào sẽ có hiệu quả hơn trong việc cải thiện biến chứng vi mạch máu, thì cho đến thời điểm hiện tại vẫn chưa có nghiên cứu rõ ràng. Loại chế phẩm insulin (nền hoặc bữa ăn) dường như không ảnh hưởng đến kết quả tim mạch.
Khởi đầu điều trị bằng nền có ưu điểm là thuận tiện và đơn giản ở những bệnh nhân sử dụng insulin lần đầu. Mặc dù insulin nền và insulin bữa ăn có hiệu quả tương tự trong việc cải thiện A1C khi liều insulin được điều chỉnh tối ưu để đạt được mục tiêu đường huyết, nhưng insulin nền làm bệnh nhân hài lòng hơn và ít xảy ra tác dụng phụ hạ đường huyết hơn. Như ví dụ:
-
- Nghiên cứu (HEART2D) được thiết kế để đánh giá tác động của insulin bữa ăn (lispro) hoặc insulin nền (NPH hai lần mỗi ngày hoặc insulin glargine một lần mỗi ngày) đối với kết quả tim mạch ở 1115 bệnh nhân sau nhồi máu cơ tim (MI) [9]. Lúc bắt đầu nghiên cứu, 50% bệnh nhân đang được dùng metformin, sulfonylurea hoặc cả hai, trong khi những bệnh nhân còn lại được điều trị bằng insulin đơn trị . Với thời gian theo dõi trung bình là 2,7 năm, thử nghiệm đã bị dừng sớm do thiếu sự khác biệt giữa các nhóm điều trị. Không có sự khác biệt giữa nhóm insulin bữa ăn và nhóm insulin nền về A1C (7,7 so với 7,8%)
Chọn insulin nền
Insulin NPH hoặc detemir dùng trước khi đi ngủ (một liều duy nhất hàng ngày ) hoặc insulin glargine hoặc degludec dùng vào buổi sáng hoặc trước khi đi ngủ là những chiến lược điều trị ban đầu hợp lý. Các chế phẩm insulin nền không khác biệt đáng kể về hiệu quả đường huyết. Trong số các chế phẩm insulin nền, insulin glargine, detemir và degludec có thể ít gây hạ đường huyết về đêm hơn so với NPH, với nhược điểm quan trọng là chi phí của chúng cao hơn.
Insulin degludec dường như có hiệu quả hạ
đường huyết tương tự như insulin glargine và trong một số nghiên cứu, tỷ lệ tác dụng phụ hạ đường huyết còn thấp hơn, đặc biệt nếu nhắm đến các mục tiêu đường huyết nghiêm ngặt
hơn. Ví dụ, trong một thử nghiệm chéo, mù đôi, kéo dài 65 tuần, 721 người trưởng thành mắc ĐTĐ-2 (A1C trung bình là 7,6%) và có ít nhất một yếu tố nguy cơ hạ đường huyết,
được chỉ định ngẫu nhiên để nhận insulin degludec hoặc insulin glargine một lần mỗi ngày. trong 32 tuần và sau đó chuyển sang
điều trị bằng insulin thay thế trong 32 tuần tiếp theo. Tỷ lệ hạ đường huyết có triệu chứng (185,6 so với 265,4 trên 100 bệnh nhân-năm phơi nhiễm) và hạ đường huyết về đêm (55,2 so với 93,6 đợt) thấp hơn ở nhóm dùng degludec (tỷ lệ 0,70, KTC 95% 0,61-0,80 và
0,58, KTC 95% 0,46- tương ứng là 0,74). Không có sự khác biệt về tình trạng hạ đường huyết nghiêm trọng (giảm không đáng kể 0,62 đợt trên 100 bệnh nhân-năm với degludec).
Việc kiểm soát đường huyết là tương tự giữa 2 nhóm (A1C 7 đến 7,1%).
Mặc dù degludec làm giảm đáng kể tỷ lệ tình trạng hạ đường huyết và hạ đường huyết về đêm, nhưng hiệu quả đó của nó còn khá khiêm tốn (trung bình, ít hơn một đợt trong mỗi 5 năm) đã được quan sát thấy trong bối cảnh mục tiêu đường huyết đói đặt ra rất chặt chẽ (71 đến 90 mg/dL).
Liều khởi đầu điều trị
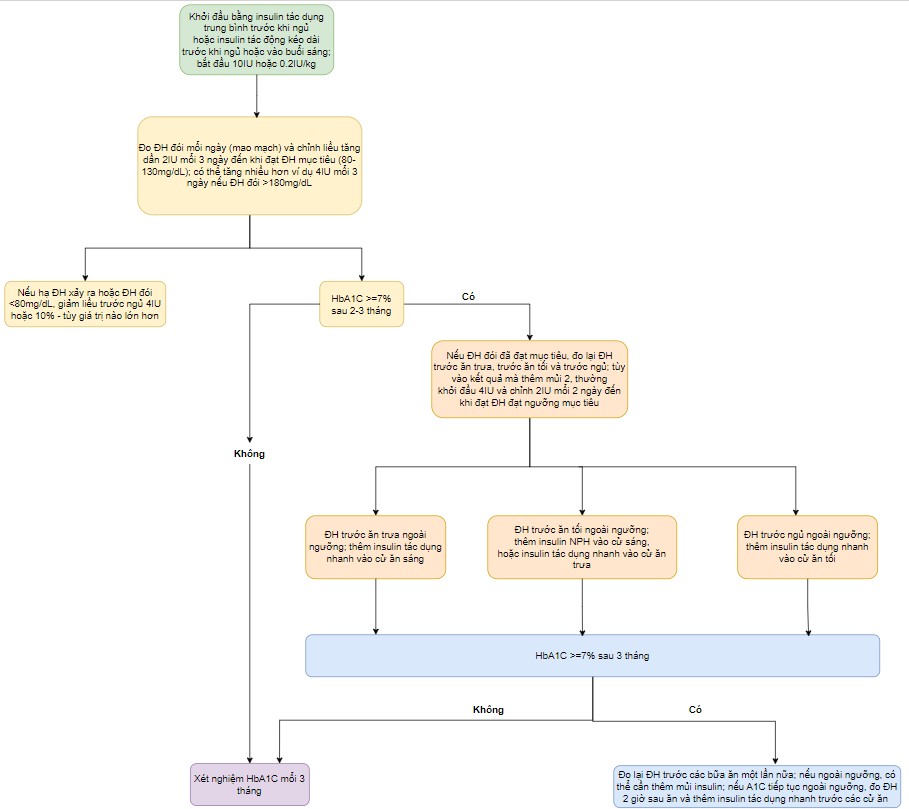
Đối với ĐTĐ-2, liều insulin ban đầu (dù dùng kèm thuốc uống, hay thay cho thuốc uống hoặc điều trị từ đầu) đều tương tự nhau. Nhiều tóm tắt về cách chọn liều đã được công bố (như hình bên dưới). Chúng tôi bắt đầu với NPH hoặc detemir trước khi đi ngủ, tiêm lúc 22:00 tối nếu bệnh nhân dự định kiểm tra
đường huyết đói lúc 7:00 hoặc 8:00 sáng, hoặc trước khi đi ngủ hoặc glargine hay degludec tiêm vào buổi sáng . Vì glargine và degludec có thể được tiêm vào bất kỳ thời điểm nào trong ngày nên thời gian sử dụng insulin glargine hoặc degludec hàng ngày tùy thuộc
vào sở thích của bệnh nhân để tạo điều kiện thuận lợi cho họ tuân thủ điều trị.
Liều ban đầu cho NPH, detemir, glargine hoặc degludec là 0,2 đơn vị mỗi kg (tối thiểu 10 đơn vị, tối đa 15 đến 20 đơn vị) mỗi ngày. Nếu mức đường huyết đói tăng rất cao (>250 mg/dL [13,9 mmol/L]), A1C > 8%, hoặc nếu bệnh nhân được biết là có khả năng đề kháng insulin rất cao, liều insulin nền ban đầu có thể cao hơn (ví dụ: 0,3 đơn vị mỗi kg hoặc tối đa 15 đến 20 đơn vị mỗi ngày). Chỉnh liều theo mức đường huyết đói và theo HbA1C mổi 3 tháng.
-
- Kết hợp điều trị – Cơ sở lý luận cho việc kết hợp thuốc uống và insulin là việc sử dụng thuốc uống với các cơ chế tác dụng khác nhau có thể giúp đạt được mục tiêu đường huyết trong khi giảm
được tổng nhu cầu insulin và cũng giảm được tác dụng phụ tăng cân. Metformin thường được tiếp tục với việc bổ sung insulin. Các thuốc khác gồm GLP-1 và SGLT2 cũng có thể được tiếp tục sử dụng khi bổ sung thêm insulin, đặc biệt nếu chúng được sử dụng vì lợi ích tim hoặc thận. Trong trường hợp không có cơ sở lý luận cho liệu pháp phối hợp, bác sỹ phải cân nhắc những lợi ích của việc thực hiện kết hợp sao cho cân bằng với nhược điểm của việc sử dụng đa thuốc và chi phí tăng lên. Thuốc ức chế Dipeptidyl peptidase 4 (DPP-4) làm tăng thêm tương tác, cũng như chi phí cho người bệnh và tác dụng của nó cũng tương đối yếu, do đó nó có thể bị ngừng khi bắt đầu sử dụng insulin.
Sulfonylureas, meglitinides và
pioglitazone thường giảm liều dần và ngừng khi bắt đầu dùng insulin, đặc biệt là insulin sau bữa ăn, do hiệu quả giảm so với các phối hợp khác và do tác dụng phụ. Tuy nhiên, có một số tình huống trong đó một trong những thuốc này có thể được kết hợp với insulin (ví dụ: sử dụng thiazolidinedione ở bệnh nhân mắc chứng loạn dưỡng mỡ và có tình trạng đề kháng insulin nặng).
-
- Đơn trị bằng insulin – Chuyển sang đơn trị bằng insulin có thể rẻ hơn so với liệu pháp kết hợp thuốc tùy thuộc vào sự kết hợp được sử dụng (nếu metformin thì rất rẻ ) .Thuốc uống có thể ngừng sử dụng khi insulin được khởi trị hoặc sau khi bệnh nhân dùng đủ liều insulin nền.
Chỉnh Liều
Liều insulin nền được điều chỉnh dựa trên mức đường huyết đói, giá trị A1C và đường huyết
trước khi đi ngủ. Đối với nhiều bệnh nhân đái
tháo đường týp 2, chỉ dùng insulin nền thường đã đủ để kiểm soát đường huyết vì nó làm giảm độc tính của glucose, do đó làm tăng tiết insulin nội sinh, và đủ để kiểm soát ĐH sau bữa ăn. Tuy nhiên, trên những bệnh nhân ĐTĐ-2 và A1C tăng liên tục mặc dù đường huyết đói đã ở mức mục tiêu hoặc những người đã phải dùng tới insulin liều rất cao, có thể họ sẽ cần dùng thêm chế phẩm insulin
trước bữa ăn, tương tự như điều trị bệnh ĐTĐ- 1.
Tăng đường huyết đói kéo dài – Nếu mức đường huyết đói trung bình cao hơn mục tiêu (thường là 130 đến 140 mg/dL [7,2 đến 7,7 mmol/L]), liều insulin nền có thể tăng từ 2 đến 4 đơn vị mổi ba ngày một lần để đạt được mục tiêu đường huyết (như lưu đồ 1) . Bằng cách này, liều insulin nền có thể được điều chỉnh trong khoảng thời gian vài tuần hoặc vài tháng. Nếu mức đường huyết đói tăng rất cao (> 250 mg/dL [13,9 mmol/L]) hoặc nếu bệnh nhân được biết là có khả năng đề kháng insulin rất cao, việc chỉnh liều có thể tích cực hơn, với việc tăng liều giảm dần khi bệnh nhân đạt được mức đường huyết mục tiêu. Bệnh nhân nên được hướng dẫn chủ động để giảm liều insulin nếu tình trạng hạ đường huyết xảy ra. Khi bệnh nhân đạt được mục tiêu đường huyết, có thể xem xét kiểm tra đường huyết giữa giấc ngủ để loại trừ tình trạng hạ đường huyết khi ngủ (điều này có thể được thực hiện khi bệnh nhân tự thức dậy giữa đêm).
Tăng A1C kéo dài mặc dù mức đường huyết đói nằm trong phạm vi mục tiêu — Đối với những bệnh nhân có mức A1C tăng kèo
dài dù mức đường huyết đói nằm trong phạm vi mục tiêu (ví dụ: 80 đến 130 mg/dL [4,4 đến 7,2 mmol/L]), chúng tôi khuyên bệnh nhân nên kiểm tra đường huyết mao mạch lúc đói, trước bữa trưa, trước bữa tối và trước khi đi ngủ đồng thời bổ sung thêm chế độ insulin . Chế phẩm Insulin trong bữa ăn thường được bắt đầu bằng một mũi tiêm duy nhất trước bữa ăn chính trong ngày, nhưng có thể áp dụng nhiều cách tiếp cận khác (như sơ đồ 1). Theo dõi ngắn hạn đường huyết ,liên tục trong hai tuần cũng có thể hữu ích trong việc chỉnh liều insulin. Tần suất theo dõi có thể giảm khi bệnh nhân đã ổn định.
Những bệnh nhân có A1C vẫn cứ cao hơn mục tiêu mặc dù đã điều chỉnh insulin, thì chế độ ăn uống và tập luyện cần được xem xét lại. Chúng tôi khuyên bệnh nhân nên tiếp tục kiểm tra đường huyết mao mạch lúc đói, trước bữa
trưa, trước bữa tối và trước khi đi ngủ trong khi chế độ điều trị sẽ được điều chỉnh thêm. Nói chung, liều lượng không phù hợp, chế độ ăn uống không khoa học và/hoặc thức ăn và liều lượng insulin không tương hợp là những nguyên nhân dẫn đến sự thất bại của điều trị bằng insulin. Tổng liều insulin hàng ngày (nền và bữa ăn) thường vượt quá 65 đến 100 đơn vị mỗi ngày và đôi khi có thể cao hơn nhiều ở bệnh nhân ĐTĐ- 2 và béo phì. Khi liều insulin nền > 80 đơn vị mỗi ngày, động học hấp thu (tỷ lệ thuận với thể tích tiêm) có thể bị thay đổi.
Trong bối cảnh này, chúng tôi sử dụng insulin nền theo liều chia hai lần mỗi ngày.
Tăng ĐH trước bữa trưa — Nếu giá trị ĐH trước bữa trưa tăng cao, các lựa chọn điều trị bao gồm bổ sung insulin bữa ăn trước khi ăn sáng, thêm GLP-1, hoặc, nếu bệnh nhân đang sử dụng insuline trước ngủ như detemir hoặc NPH, thêm liều NPH hoặc detemir cử thứ hai vào buổi sáng. Việc điều chỉnh chế độ ăn vào bữa sáng cũng có thể có hiệu quả.
Khi chế phẩm insulin được dùng là detemir, việc kiểm soát đường huyết trong khoảng thời gian 24 giờ có thể sẽ ổn định hơn khi bệnh nhân dùng tiêm 2 lần mỗi ngày (bảng 1) . Nếu
mục tiêu là kiểm soát tình trạng tăng đường huyết kéo dài bằng một insulin đơn giản và không tốn kém quá thì NPH hai lần mỗi ngày sẽ là lựa chọn hợp lý và có hiệu quả. Chiến lược chuyển từ NPH dùng 1 lần/ngày sang NPH 2 lần/ngày hoặc detemir là tổng liều insulin hàng ngày sẽ khoảng 80% liều insulin nền hiện tại trước khi đi ngủ, sử dụng khoảng 50 đến 70% lượng insulin đó dùng vào buổi sáng và 50% đến 30% lượng còn lại dùng khi đi ngủ. Chúng tôi thường sử dụng detemir chia liều và NPH 70/30. Đối với những bệnh nhân còn xa mục tiêu đường huyết, tổng liều detemir hàng ngày có thể được chia thành các liều đều nhau.
Tăng ĐH trước ăn tối hoặc trước khi ngủ – Nếu giá trị đường huyết tăng cao
trước bữa tối và/hoặc trước khi đi ngủ, chúng tôi thường bổ sung insulin bữa ăn. Có thể tiêm
insulin tác dụng ngắn (loại regular) hoặc insulin tác dụng nhanh trước bữa trưa và/hoặc bữa tối. Thường đơn giản hơn là tư vấn chia những bữa trưa nhỏ hơn, sau đó tiêm thêm một mũi insulin trước bữa tối, đối với nhiều người, bữa tối mới là bữa ăn chính nhất trong ngày. Nếu bữa trưa là bữa ăn chính nhất trong ngày, có thể sử dụng phương pháp ngược lại (ví dụ: phủ insulin trước bữa ăn, ăn bữa tối ít hơn).
Đối với những bệnh nhân đang sử dụng NPH hoặc detemir lúc ngủ, có tình trạng tăng ĐH
trước trước bữa ăn tối, việc bổ sung thêm một liều insulin NPH hoặc detemir khác vào bữa sáng là một lựa chọn hợp lý, đặc biệt nếu lượng đường huyết trước bữa trưa cũng tăng cao. Thêm GLP-1 là một lựa chọn khác.
Kết hợp insulin bữa ăn và insulin nền — Đối với bệnh nhân ĐTĐ-2 cần dùng insulin bữa ăn, mục tiêu là điều chỉnh liều insulin tác dụng ngắn hoặc insulin tác dụng nhanh ngay trước bữa ăn, và do đó, chúng tôi ưu tiên giữ nguyên liều insulin nền và chỉnh liều insulin tác dụng nhanh trước bữa ăn. Bệnh nhân có thể rút insulin trước bữa ăn và NPH trong cùng một ống tiêm , nhưng glargine, degludec và detemir không thể trộn với insulin tác dụng nhanh. Trong trường hợp tiêm insulin
nhiều lần mỗi ngày, các thuốc uống khác ngoài metformin thường được ngừng sử dụng để giảm chi phí và hạn chế tình trạng đa thuốc.
Tuy nhiên, GLP-1 dạng uống hoặc tiêm cũng có thể được tiếp tục.
-
-
- Lựa chọn insulin dùng cho bữa ăn – Việc lựa chọn insulin dùng cho bữa ăn dựa trên tình trạng sẵn có cảu thuốc, sở thích của bệnh nhân, chi phí và phạm vi chi trả của người bệnh. Khả năng tiêm insulin tác dụng nhanh trước bữa ăn 10 đến 15 phút (trái ngược với 30 đến 45 phút trước bữa ăn bằng insulin [tác dụng ngắn] thông thường) sẽ thuận tiện hơn và có thể cải thiện sự tuân thủ điều trị. Trong một phân tích tổng hợp gồm 10 nghiên cứu ngẫu nhiên (bao gồm 2751 bệnh nhân ĐTĐ-2) so sánh insulin tác dụng nhanh với insulin regular
-
dưới dạng liều bolus trước bữa ăn, không thấy sự khác biệt đáng kể nào về nồng độ A1C hoặc số lần hạ đường huyết.
-
-
- Liều insulin trước bữa ăn
-
– Liều insulin tối ưu trước bữa ăn phụ thuộc vào nhiều yếu tố, bao gồm giá trị đường huyết hiện tại và mục tiêu muốn đạt, hàm lượng carbohydrate trong bữa ăn và hoạt động thể lực. Liều khởi đầu điển hình là khoảng 4 đến 6 đơn vị hoặc 10 phần trăm liều insulin nền (sơ đồ 1). Có thể tăng liều ba ngày một lần cho đến khi đạt
được mục tiêu đường huyết sau ăn.
Việc tăng liều insulin bữa ăn bao nhiêu phụ thuộc vào lượng insulin bữa ăn mà bệnh nhân đang sử dụng. Sử dụng quy luật ngón tay cái:
- ≤10 đơn vị – tăng mổi 1 đơn vị
- 11 to 20 đơn vị – tăng mổi 2 đơn vị
- >20 đơn vị – tăng mổi 5 đơn vị
- Chế phẩm insulin trộn – Một số loại insulin có sẵn trên thị trường ở dạng trộn sẵn. Hầu hết các chế phẩm trộn sẵn (hai pha) đều chứa insulin tác dụng trung bình và insulin tác dụng ngắn hoặc insulin tác dụng nhanh. Hạn chế chính của insulin trộn sẵn là khả năng linh hoạt trong việc điều chỉnh liều lượng sẽ bị hạn chế. Tuy nhiên, insulin trộn sẵn là một lựa chọn hợp lý cho những bệnh nhân mắc ĐTĐ-2 đang dường huyết ổn định đang dùng insulin tác dụng trung bình và insulin tác dụng ngắn hoặc những người có thể điều chỉnh chế độ ăn của mình để phù hợp với động học của insulin trộn. Insulin trộn sẵn hoạt động tốt nhất khi có ít sự thay đổi hàng ngày trong bữa sáng, bữa trưa và bữa tối (với bữa
trưa ăn ít) hoặc trên bệnh nhân có tình trạng đề kháng insulin đến mức họ khó có thể bị hạ đường huyết sau bữa ăn dù ít hơn bình thường. Insulin
trộn sẵn hiếm khi được sử dụng làm liệu pháp insulin ban đầu cho những bệnh nhân mong muốn chế độ insulin đơn giản.
Các chế phẩm tác dụng nhanh được trộn sẵn có thể kém hiệu quả hơn một chút trong việc kiểm soát đường huyết so với dùng insulin nền kết hợp liều bolus đã được chuẩn độ đầy đủ. Trong một thử nghiệm nhãn mở, 708 bệnh nhân mắc ĐTĐ- 2
được điều trị dưới mức tối ưu bằng metformin và sulfonylurea được phân ngẫu nhiên vào nhóm insulin trộn (tiêm hai lần mỗi ngày), insulin bữa ăn (ba lần mỗi ngày) hoặc vào nhóm insulin nền detemir (một hoặc hai lần mỗi ngày). Không có sự khác biệt về mức A1C trung bình giữa ba nhóm (lần lượt là 7,1, 6,8 và
6,9%), nhưng số lượng bệnh nhân đạt mức A1C
≤6,5% nhiều hơn đáng kể ở nhóm sử dụng insulin nền và nhóm bữa ăn khi so với nhóm insulin trộn (43, 45 và 32%). Phần lớn cả ba nhóm điều trị đều sử dụng loại insulin thứ hai,
theo phác đồ. Bệnh nhân trong nhóm nền có ít đợt hạ đường huyết nhất.
Trong các nghiên cứu khác, các chế phẩm tác dụng nhanh được trộn sẵn thường gây hạ đường huyết nhẹ và tăng cân nhiều hơn khi so với insulin tác dụng kéo dài
hoặc các chế phẩm thuốc uống.
Insulin trộn phải luôn được dùng trước bữa ăn vì thành phần tác dụng nhanh nhằm mục đích bù đắp lượng insulin ăn vào sau bữa ăn. Để khởi trị, hãy tính tổng liều hàng ngày dựa trên cân nặng (0,2 đơn vị mỗi kg [tối thiểu 10 đơn vị, tối đa 15 đến 20 đơn vị] mỗi ngày) hoặc dựa trên liều insulin
trước đó. Một cách tiếp cận là dùng 2/3 tổng liều hàng ngày trước bữa sáng và 1/3 trước bữa tối.
Insulin trộn sẵn nên được định lượng tương ứng với lượng ăn vào trong bữa ăn và có thể cần giảm liều cho các bữa ăn nhỏ hơn. Liều ban đầu được điều chỉnh dựa trên mức
đường huyết. Nếu tình trạng tăng đường huyết trước bữa trưa và trước bữa tối vẫn tiếp diễn, có
thể tăng liều buổi sáng từ 2 đến 3 đơn vị sau mổi 2 đến 3 ngày. Nhưng một điều đáng lưu ý và dễ bị sụp hố là nhắm mục tiêu điều trị tăng đường huyết trước bữa tối (tăng liều buổi sáng) có thể dẫn đến
hạ đường huyết trước bữa trưa, làm nổi bật thách thức của việc sử dụng insulin trộn. Do đó, có thể cần phải nới lỏng mục tiêu đường huyết để sử dụng insulin trộn một cách an toàn.
Chuyển đổi giữa các insulin nền
-
- Chuyển từ insulin nền 2 lần/ngày sang 1 lần/ngày – Nếu bệnh nhân đang dùng NPH hoặc detemir hai lần mỗi ngày và muốn chuyển sang dùng liều insulin nền một lần mỗi ngày thì việc chuyển sang dùng glargine (U-100 hoặc U-300) hoặc degludec một lần mỗi ngày có thể được thực hiện một cách an toàn bằng cách giảm tổng liều insulin nền hàng ngày xuống 10 đến 20 phần trăm và chỉnh liều lại dựa trên mức
đường huyết. Nếu bệnh nhân bị tăng đường huyết nặng mà không bị hạ đường huyết và xác nhận tuân thủ liều tốt, tổng liều hàng ngày có thể sử dụng tương đương mà không cần giảm liều.
-
- Chuyển đổi giữa các loại insulin nền dùng một lần mỗi ngày – Nếu bệnh nhân chuyển từ dùng detemir dùng một lần mỗi ngày sang glargine dùng một lần mỗi ngày (U-100 hoặc U-300 glargine) hoặc degludec, chúng tôi sẽ giảm liều từ 10 đến 20 phần trăm và chỉnh liều lại dựa trên về mức độ glucose trong máu. Nếu bệnh nhân bị tăng
đường huyết nặng, có thể sử dụng tổng liều tương đương hàng ngày.
Insulin nền dùng trước khi đi ngủ sẽ ức chế quá trình tân tạo glucose ở gan về đêm. Các loại insulin nền tác dụng dài hơn có thể ít tác dụng hơn qua đêm và lại có nhiều tác dụng hơn vào ngày hôm sau, điều này sẽ không gây hại. Tuy nhiên, chúng tôi thường giảm liều ban đầu để tránh nguy cơ hạ đường huyết, sau đó tăng liều khi cần thiết để duy trì đường huyết mục tiêu.
XỬ LÝ CÁC BIẾN CỐ LÚC DÙNG INSULIN
Hạ đường huyết
Tăng nguy cơ hạ đường huyết là một biến chứng tiềm ẩn khi điều trị insulin. Tuy nhiên,
bệnh nhân ĐTĐ-2 được điều trị bằng insulin ít bị hạ đường huyết hơn nhiều so với bệnh nhân ĐTĐ-1 với mức A1C tương tự .Trong nghiên cứu so sánh hiệu quả GRADE với thời gian
theo dõi trung bình 5 năm, tỷ lệ hạ đường huyết nặng ở nhóm glargine điều trị kèm với metformin (1,3%) thấp hơn so với glimepiride (2,2%) và có thể so sánh với liraglutide (1 phần trăm) và sitagliptin (0,7 phần trăm).
Mặc dù insulin nền ít gây hạ đường huyết hơn insulin bữa ăn , hạ đường huyết có thể xảy ra khi tăng liều insulin nền mục đích kiểm soát luôn đường huyết sau ăn. Nếu sau đó bệnh nhân ăn ít hơn bình thường, hạ đường huyết có thể xảy ra . Ngoài ra, một số bệnh nhân có thể bị hạ đường huyết vào ban ngày khi dùng liều insulin nền để kiểm soát lượng đường huyết đói. Cả hai tình huống này đều có thể dẫn đến việc bắt buộc phải ăn vặt nhiều hơn, điều này có thể gây tăng cân liên quan đến sử dụng insulin. Vấn đề này có thể được xác định bằng cách hỏi xem bệnh nhân có triệu chứng hạ đường huyết khi bỏ bữa hoặc ăn nhẹ để ngăn ngừa hạ đường huyết hay không. Cần xác định các yếu tố gây hạ đường huyết tiềm ẩn khác (ví dụ, thay đổi chế độ ăn uống hoặc hoạt động thể lực, sử dụng rượu bia). Những
bệnh nhân thay đổi đáng kể về chế độ ăn uống (ví dụ: bắt đầu chế độ ăn ketogenic) có thể cần giảm đáng kể liều insulin (ví dụ: giảm ≥50%).
Hạ đường huyết về đêm – Nên giảm liều insulin nền (liều trước khi đi ngủ nếu dùng hai lần mỗi ngày) 4 đơn vị hoặc 10%, tùy theo mức nào lớn hơn . Nếu không có yếu tố thúc đẩy hạ đường huyết rõ ràng (ví dụ, bỏ bữa hoặc tăng hoạt động thể chất, tăng lượng rượu), cần giảm liều nhiều hơn (20 đến 30%), và tái chỉnh liều nếu cần. Nếu bệnh nhân đang dùng NPH trước khi đi ngủ, một giải pháp thay thế là chuyển sang dùng detemir, insulin glargine hoặc degludec ở mức 80 đến 90% tổng liều hàng ngày hiện tại.
Trong số các chế phẩm insulin nền, insulin glargine, detemir và degludec có thể có một số lợi ích lâm sàng tương đối khi so với NPH khi theo đuổi mục tiêu kiểm soát đường
huyết chặt chẽ (ít triệu chứng và hạ đường huyết về đêm) với nhược điểm quan trọng nhất là giá thành cao.
- Hạ đường huyết ban ngày – Nếu bệnh nhân đang dùng insulin bữa ăn, nên giảm liều vào (các) bữa ăn thích hợp (ví dụ: giảm insulin bữa ăn sáng nếu hạ đường huyết xảy ra giữa bữa sáng và bữa trưa). Nếu hạ đường huyết không nghiêm trọng, cách tiếp cận điển hình là giảm liều dựa trên lượng insulin mà bệnh nhân dùng vào bữa ăn như nêu sau đây:
- ≤10 đơn vị – giảm mổi 2 đơn vị
- 11 to 20 đơn vị – giảm mổi 2 đơn vị
- >20 đơn vị – giảm mổi 6-10 đơn vị hoặc giảm 50% liều đang dùng
Nếu hạ đường huyết nghiêm trọng hoặc trầm trọng, cần thận trọng giảm liều đáng kể (từ 20 đến 50%) và lặp lại việc chỉnh liều hoặc ngừng hẳng insulin bữa ăn và bắt đầu lại/điều chỉnh lại nếu cần.
Bệnh nhân nên được hướng dẫn cách điều chỉnh liều lượng bữa ăn tùy theo khẩu phần bữa ăn và hàm lượng carbohydrate. Ngoài ra, bệnh nhân nên được hỏi về thời gian dùng insulin bữa ăn và nhắc bệnh nhân về thời gian thích hợp nếu bệnh nhân dùng sai thời điểm (ví dụ, nếu bệnh nhân dùng insulin sau bữa ăn thay vì trước bữa ăn).
Nếu bệnh nhân không dùng insulin bữa ăn, nên giảm liều insulin nền (4 đơn vị hoặc 10%, tùy theo mức nào lớn hơn); cũng có thể nên thận trọng khi chuyển sang insulin analog , tác dụng kéo dài, không đỉnh ở những bệnh nhân nhạy cảm với insulin bị hạ đường huyết. Nếu tăng đường huyết tái phát sau bữa ăn (dựa trên việc theo dõi chỉ số đường huyết), lúc này nên bổ sung insulin vào
bữa ăn để bù đắp cho những thay đổi trong giờ ăn.
- Hạ đường huyết nặng – Nếu bệnh nhân có biến cố hạ đường huyết nặng, đặc biệt là trường hợp nặng đến nổi phải cần sự hỗ trợ của người khác để bổ sung carbohydrate nhằm điều trị triệu chứng tức thời (hạ đường huyết nặng) và không có thay đổi rõ ràng nào trong chế độ ăn uống hoặc hoạt động để giải thích cho tình trạng hạ đường huyết kia, thì với các bệnh nhân này nên giảm liều mạnh tay (ví dụ, giảm từ 20 đến 50%) và lặp lại việc chỉnh liều insulin nền (và/hoặc ngừng dùng insulin bữa ăn và bắt đầu lại/chỉnh liều lại, nếu cần).
Đề kháng insulin
Trên những bệnh nhân đề kháng insulin nặng (ví dụ, cần tổng cộng hơn 200 đơn vị insulin mỗi ngày), insulin đậm đặc có thể được sử dụng để kiểm soát tình trạng tăng đường huyết. Công thức insulin đậm đặc cho phép sử dụng liều tương đương với thể tích nhỏ hơn insulin U-100 và không cần tiêm nhiều lần để cung cấp liều cao. Thể tích insulin được tiêm nhỏ hơn sẽ cải thiện động học hấp thụ. Cần theo dõi chặt chẽ phản ứng của từng bệnh nhân vì insulin đậm đặc rất mạnh và tác dụng của nó thường biến hóa khác với dược động học trên nhãn sản xuất.
- Insulin regular U-500 – Insulin regular U-500 hiện được sử dụng ít thường xuyên hơn so với trước đây do có sẵn các GLP-1 mạnh cũng như các dạng tương tự insulin đậm đặc. Tuy nhiên, Insulin U-500 đã và có thể tiếp tục được sử dụng cho bệnh nhân béo phì, kháng insulin
qua trung gian miễn dịch, bất thường di truyền của thụ thể insulin và kháng insulin nghiêm trọng do loạn
dưỡng mỡ . Dược động học có thể rất khác nhau tùy từng bệnh nhân và hạ đường huyết vẫn là một nguy cơ
tiềm ẩn. Insulin regular U-500 có cả đặc tính nền và đặc tính bữa ăn; liều cao hơn có thể dẫn đến thời gian tác dụng của insulin dài hơn đáng kể,
tương tự như NPH.
- U-300 glargine – Glargine 300 đơn vị/mL rất giống với glargine thường nhưng có thể tích bằng 1/3 so với cùng liều glargine 100 đơn vị/mL. Nó có sẵn ở dạng bút được nạp sẵn và cửa sổ liều lượng hiển thị số lượng đơn vị insulin sẽ được phân phối trên thân bút. U-300 glargine được sử dụng cho những người có hoặc không có tình trạng đề kháng insulin và có thể được thay thế trên cơ sở mỗi đơn vị tương đương. Dược động học hơi khác một chút, ít tác dụng đỉnh và thời gian tác dụng dài hơn. Do đó, glargine 300 đơn vị/mL giống với degludec hơn là glargine 100 đơn vị/mL.
- U-200 lispro – Là insulin analog tác dụng nhanh, đậm đặc (ví dụ U-200 lispro) chứa 200 đơn vị/mL thay vì 100 đơn vị/mL trong chế phẩm U-
100. Chúng rất hữu ích cho những bệnh nhân cần tiêm insulin liều cao và có sẵn trong bút tiêm để giảm thiểu nguy cơ sai sót về liều lượng. Cửa sổ liều lượng hiển thị số lượng đơn vị insulin sẽ được kèm theo và không cần chuyển đổi.
Tăng cân do sử dụng insulin – Bệnh nhân bắt đầu điều trị bằng insulin nên nhận thức
được khả năng tăng cân và cần chú trọng đến chế độ ăn uống và điều chỉnh lối sống để ngăn ngừa tình trạng này. Điều quan trọng là phải
hướng dẫn và tư vấn bệnh nhân về việc giảm liều insulin, tăng hoạt động thể chất và thay đổi chế độ ăn uống cũng như giảm sử dụng rượu bia để giảm nguy cơ hạ đường huyết và tăng cân.
Nguồn: Uptodate – dịch bởi Bs.Nguyễn Hoàng Lộc
Lưu đồ khởi trị insulin – source: Initiation and adjustment of insulin regimens in type 2 diabetes mellitus – Uptodate
 Thank you
Thank you
Để lại một bình luận