
Áp lực đẩy: áp dụng khái niệm tại giường bệnh
Bản dịch của BS. Đặng Thanh Tuấn
Áp lực đẩy (∆P) được định nghĩa là áp lực căng trên áp lực dương cuối thì thở ra (PEEP) được áp dụng cần thiết để tạo ra thể tích khí lưu thông (Vt). Nó được tạo ra bởi các lực đàn hồi phát triển trong quá trình bơm phồng phổi theo chu kỳ. Do đó, áp lực đẩy bị ảnh hưởng bởi biên độ bơm phồng phổi theo chu kỳ và độ đàn hồi của phổi và thành ngực, và nó có thể được biểu thị bằng tỷ số giữa Vt và độ giãn nở của hệ hô hấp (Crs) (∆P = Vt/Crs) [1]. Độ đàn hồi (và nghịch đảo của nó, độ giãn nở) của phổi phản ánh kích thước chức năng của phổi. Vì độ đàn hồi đặc hiệu (speciic elastance) của phổi em bé không bị ảnh hưởng bởi hội chứng nguy kịch hô hấp cấp tính (acute respiratory distress syndrome – ARDS) (tức là các vùng phổi không bị ảnh hưởng vẫn duy trì các đặc tính cơ học bình thường của chúng), nên sự gia tăng độ đàn hồi tổng thể của phổi phản ánh sự mất thể tích phổi: độ đàn hồi tăng khi số lượng đơn vị phổi (acini) có sẵn để tham gia vào quá trình thông khí theo chu kỳ bị giảm. Mối quan hệ giữa độ đàn hồi và thể tích phổi đã được chứng minh trong nghiên cứu chụp cắt lớp vi tính (CT) cổ điển của Gattinoni và cộng sự [2]. Ở những bệnh nhân được đặt nội khí quản, ∆P có thể dễ dàng được tính toán trong điều kiện bán tĩnh là áp lực cao nguyên (Pplat) trừ đi PEEP tổng [3]. Tuy nhiên, mặc dù phép đo này hoàn toàn đáng tin cậy ở những bệnh nhân hoàn toàn thụ động, nhưng nó có thể dẫn đến sai số do ảnh hưởng của các cơ hô hấp ở bệnh nhân khi thở máy hỗ trợ.
Tại sao áp lực đẩy lại có liên quan về mặt lâm sàng?
Tầm quan trọng của ∆P lần đầu tiên được mô tả trong phân tích hậu kiểm của nhiều thử nghiệm ngẫu nhiên đánh giá việc sử dụng thông khí Vt thấp hoặc PEEP cao hơn ở những bệnh nhân mắc ARDS [1]. Kết quả của phân tích này cho thấy trong quá trình thở máy có kiểm soát, mức ∆P cao hơn có liên quan độc lập với tỷ lệ tử vong, bất kể mức PEEP, Vt hay Pplat. Ngoài ra, ∆P đã được chứng minh là trung gian cho mối liên quan giữa Vt và tỷ lệ tử vong hoặc giữa PEEP và tỷ lệ tử vong. Tương tự như vậy, ∆P cao hơn cũng có liên quan đến sự phát triển ARDS ở những bệnh nhân không có bằng chứng lâm sàng về tổn thương phổi tại thời điểm đặt nội khí quản [4].
Một phân tích thứ cấp gần đây về năm thử nghiệm ngẫu nhiên cho thấy lợi ích về tỷ lệ tử vong khi giảm Vt ở những bệnh nhân mắc ARDS chỉ được quan sát thấy ở những bệnh nhân có độ đàn hồi cao của hệ hô hấp, cho thấy rằng căng thẳng phổi, chứ không phải bản thân tình trạng căng phồng phổi, là yếu tố quyết định tổn thương phổi do máy thở (VILI) [5]. Khi ∆P thấp (< 15 cmH2O), không có sự khác biệt về tỷ lệ tử vong giữa Vt cao (12 mL/kg) và Vt thấp (6 mL/kg). Do đó, việc thiết lập Vt theo ∆P có thể cho phép giảm thêm Vt khi nó tạo ra căng thẳng phổi quá mức. Tương tự như
vậy, cho phép Vt cao hơn ở những bệnh nhân có độ đàn hồi thấp có thể tạo điều kiện cho việc thở tự nhiên và giảm thiểu nhu cầu dùng thuốc an thần [5]. Tuy nhiên, cho đến nay, vẫn chưa có thử nghiệm lâm sàng nào tập trung vào kết quả lâm sàng để đánh giá chắc chắn tác dụng của việc hiệu chỉnh Vt theo mục tiêu ∆P.
Tần suất bơm phồng theo chu kỳ thở cũng có thể góp phần vào VILI. Tuy nhiên, dữ liệu gần đây đã chỉ ra rằng tác động của việc giảm ∆P đối với việc giảm tỷ lệ tử vong mạnh hơn bốn lần so với tác động của việc giảm tần số hô hấp (RR) [6]. Nói cách khác, việc giảm ∆P 1 cmH2O có thể liên quan đến lợi ích trừ khi RR cần phải tăng thêm 4 nhịp thở/phút trở lên do nhiễm toan hô hấp. Trong trường hợp này, trong điều kiện đẳng áp, tác động tổng thể sẽ bằng không. Do đó, các tác động có hại của tình trạng tăng CO2 máu, chẳng hạn như tăng nguy cơ suy thất phải, nên được cân bằng với việc cải thiện thông khí phút bằng cách tăng RR.
Đo áp lực đẩy tại giường như thế nào?
Trong quá trình thông khí kiểm soát, khi không có sự bất đồng bộ, ∆P có thể dễ dàng được tính toán trong điều kiện bán tĩnh bằng cách thực hiện một lần tạm dừng hít vào ngắn trong 0,2–0,3 giây để đo Pplat. Ở những bệnh nhân ARDS, ∆P an toàn có khả năng là < 15 cmH2O [1].
Ở những bệnh nhân thở tự nhiên được thở máy, có thể thực hiện phép đo tương tự bằng cách dùng thuốc an thần tác dụng ngắn (phải xem xét kỹ lưỡng và tránh các tín hiệu kích hoạt ngược). Nếu nỗ lực hít vào vẫn tiếp diễn, có thể thêm một liều thuốc giãn cơ tác dụng ngắn. Sau đó, có thể đo Pplat và tổng PEEP và tính Crs. Sau khi thực hiện phép đo này, vì chúng ta biết Vt theo từng nhịp thở, người ta có thể nhanh chóng biết được bệnh nhân thở bao nhiêu ∆P ở mỗi lần hít vào (∆P = Vt/Crs) (Hình 1a và b).
Ngoài ra, nếu chúng ta muốn tránh thuốc an thần, chúng ta có thể ước tính hợp lý ∆P bằng một số thao tác đơn giản và thực tế được mô tả gần đây. Thao tác đầu tiên yêu cầu tắc nghẽn cuối thì hít vào trong quá trình thở tự nhiên (chủ yếu được xác nhận
cho thông khí hỗ trợ áp lực), ở những bệnh nhân đạt được sự thư giãn hoàn toàn của các cơ hô hấp. Ở những bệnh nhân này, sẽ có được phép đo áp lực đường thở ổn định. Áp lực đẩy thu được bằng cách giữ cuối thì hít vào trong PSV có tương quan với tỷ lệ tử vong trong một nghiên cứu [7] và có thể được tính bằng cách chỉ cần trừ Pplat trừ PEEP (Hình 1c), mặc dù Pplat có thể khó đo ở những bệnh nhân có nỗ lực cơ hô hấp mạnh và nỗ lực thở ra tích cực
[8] (Hình 1d). Thao tác này yêu cầu kiểm tra trực quan các đường cong theo dõi áp lực đường thở. Các đường theo dõi Pplat không ổn định nên bị loại bỏ [9], nhưng chúng không phổ biến.
Phương pháp thứ ba có thể được sử dụng để ước tính “∆P động”, bao gồm các lực cản được tạo ra trong quá trình hít vào, dẫn đến ước tính quá cao một chút của ∆P, do đó được gọi là ∆P động. Trong trường hợp này, chúng tôi thực hiện một lần tạm dừng thở ra và để bệnh nhân thở. Sự dao động trong áp lực đường thở do nỗ lực hít vào của bệnh nhân tạo ra khi đường thở bị tắc nghẽn (∆Pocc) có thể được sử dụng để ước tính thành phần của ∆P động được tạo ra bởi các cơ hít vào (Pmusc) trong quá trình thở không bị tắc nghẽn: Pmusc = – 0,75 × Pocc. Pocc được nhân với 0,75 để ước tính Pmusc để tính đến sự khác biệt trong các lực được tạo ra trong quá trình co cơ gần tĩnh so với gần đẳng trương (một hàm của mối quan hệ lực-vận tốc của cơ hoành). Hệ số hiệu chỉnh này đã được suy ra theo kinh nghiệm và được xác nhận trong nghiên cứu ban đầu mô tả việc sử dụng Pocc [10]. Thành phần máy thở của ∆P được ước tính theo mức hỗ trợ áp lực đặt trên PEEP (hoặc theo áp lực đỉnh trên PEEP) (Hình 1e):
Pdyn = PSVset − (0,75 × ∆Pocc)
Xét đến thành phần sức cản vốn có trong phép tính này, các giá trị ∆P động được tính theo phương pháp này cần được chú ý khi vượt quá 3–5 cmH2O so với ước tính do phương pháp thứ hai (tạm dừng hít vào). Trong trường hợp này, có thể nghi ngờ hoạt động của cơ thở ra và có thể sử dụng phương pháp đầu tiên để có được phép đo ∆P đáng tin cậy hơn. Hơn nữa, vì sự thư giãn của các cơ thở ra gây ra sự gia tăng Vt (tương ứng với thể tích do phục hồi áp lực xuyên phổi ở cuối quá trình thở ra), hoạt động này làm tăng ∆P thực sự (Hình 1f).
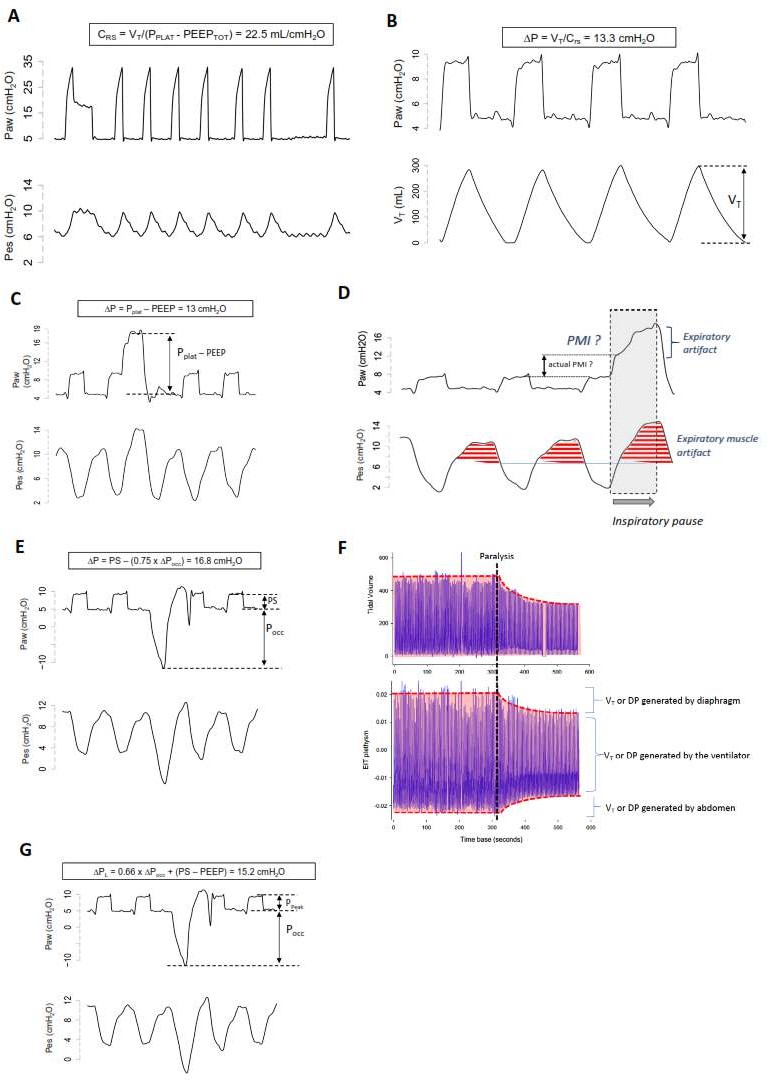
Hình 1 Bốn phương pháp ước tính áp lực đẩy (∆P) trong quá trình thở tự nhiên: Biểu đồ đại diện của áp lực thực quản và áp lực gần thu được từ một bệnh nhân tại các thời điểm khác nhau. Bệnh nhân được thở máy dưới chế độ thở hỗ trợ áp lực và sau đó được gây liệt cơ bằng succinylcholine (A). Bệnh nhân được theo dõi bằng EIT và trong quá trình liệt cơ, chúng tôi đảm bảo rằng thông khí phút giống như trong quá trình thở máy hỗ trợ áp lực. Chúng tôi cũng đảm bảo rằng EELZ (đại diện cho EELV) không thay đổi đáng kể để hoạt động ở cùng một thể tích phổi toàn cục, với cơ chế tương tự của hệ hô hấp. Sau khi thực hiện một lần tạm dừng hít vào và thở ra ngắn (0,5 giây), chúng tôi đã đo độ giãn nở bán tĩnh và áp lực đẩy (lần lượt là 22,5 mL/cmH2O và 13,3 cmH2O). Trong bảng B, bệnh nhân được thở máy dưới chế độ thở hỗ trợ áp lực được đặt ở mức 5 cmH2O, khi chúng tôi đo VT = 300 mL. ∆P sau đó được tính là Vt/Crs = 300/22,5 = 13,3 cmH2O. Lưu ý rằng chúng tôi đảm bảo rằng VT ở bảng A giống với VT ở bảng B. Ở bảng C, bệnh nhân cũng được thở máy dưới chế độ thở hỗ trợ áp lực được đặt ở mức 5 cmH2O, sau đó chúng tôi thực hiện tạm dừng hít vào. Lưu ý rằng áp lực đường thở tăng đáng kể trong thời gian tạm dừng, cho thấy nỗ lực ẩn mà bệnh nhân đã thực hiện trong giai đoạn hít vào trước khi tạm dừng (bây giờ được chuyển đổi thành áp lực đàn hồi). Lưu ý rằng các dao động âm trong áp lực thực quản là đều đặn trong các chu kỳ, với ít sự can thiệp của thao tác. Sau đó, ∆P được tính là Pplat – PEEP = 13 cmH2O (cho thấy sự đánh giá thấp không đáng kể). Ở bảng D, chúng tôi có thể quan sát tác động của hoạt động cơ thở ra trong thời gian tạm dừng hít vào tạo ra sự gia tăng liên tục áp lực đường thở trong thời gian tạm dừng hít vào. Các cơ thở ra được kích hoạt trong mỗi nhịp thở (chúng ta có thể nhận ra điều này bằng cách so sánh áp lực thực quản trong quá trình liệt cơ). Hơn nữa, có một đáp ứng rõ ràng đối với thao tác này với sự co mạnh hơn của các cơ thở ra. Trong bảng E, bệnh nhân vẫn được thở máy dưới chế độ thông khí hỗ trợ áp lực được đặt ở mức 5 cmH2O, sau đó chúng tôi thực hiện tạm dừng thở ra. Lưu ý rằng áp lực đường thở giảm đáng kể trong thời gian tạm dừng, với cường độ tương tự (gọi là Pocc, = – 15,7 cmH2O) khi áp lực thực quản giảm, cho thấy nỗ lực dự định sẽ thực hiện trong nhịp thở tiếp theo. Lưu ý rằng sự dao động âm trong áp lực thực quản cao hơn một chút trong hơi thở bị tắc nghẽn khi so sánh với những lần trước đó. Điều này được giải thích bằng hệ số K (0,75) được sử dụng trong phép tính này: ∆P = PS − (0,75 × Poccl) = 5 − (0,75 × − 15,7) = 16,8 cmH2O. Phương pháp này biểu diễn ∆P động, ước tính quá mức giá trị trước đó là 3,8 cmH2O. Một phần lớn của sự ước tính quá mức này là do các lực cản không được trừ khỏi áp lực đường thở/cơ khi sử dụng phương pháp này. Trong bảng F, chúng ta có thể quan sát Vt và máy đo thể tích cắt lớp trở kháng điện trước và sau khi bị liệt (đường chấm đen). Như chúng ta có thể quan sát, trước khi liệt cơ, lượng ∆P và Vt được tạo ra là tổng của sự giãn cơ thở ra, máy thở và nỗ lực hít vào. Sau khi bị liệt cơ, ∆P và Vt được tạo ra chỉ phụ thuộc vào máy thở vì hoạt động của cơ bị loại bỏ hoàn toàn. Trong bảng G, chúng tôi sử dụng cùng một đường vẽ và tạm dừng thở ra như trong bảng
E. Nhưng chúng tôi đã sử dụng nó để tính toán ∆P xuyên phổi động (∆PL). Trong trường hợp này, hệ số 0,66 về bản chất trừ đi thành phần thành ngực có liên quan đến tất cả các phép tính trước đó. Tuy nhiên, nó đánh giá quá cao phương pháp B và C vì nó không nhằm mục đích trừ đi lực cản như trong phương pháp D. Chúng ta có thể cho rằng nó biểu thị đỉnh của ứng suất phổi động trong quá trình thở tự nhiên. Các nghiên cứu xác nhận mức độ an toàn cho biến này đang được tiến hành
Cuối cùng, phép đo Pocc cũng đã được xác nhận trong nhiều nghiên cứu [10, 11] để ước tính áp lực đẩy xuyên phổi động (∆PLdyn) như một đại diện thay thế cho căng thẳng phổi, tức là thành phần của ∆P dành để chỉ làm căng phổi và cũng bao gồm các lực cản để di chuyển khí qua đường thở và ống nội khí quản (ET) (Hình 1g):
Các phương pháp dựa trên Pocc có thể ước tính quá cao áp lực căng phổi tĩnh do các lực cản cần thiết để di chuyển khí qua đường thở và ống ET. Tuy nhiên, trước đây đã có ý kiến cho rằng áp lực động (thay vì áp lực tĩnh) có thể có liên quan hơn trong quá trình thở tự nhiên dưới sự hỗ trợ của máy thở do sự thay đổi theo vùng về áp lực căng
PLdyn
= (Ppeak − PEEP) − (0,66 ∗ Pocc)
phổi trong điều kiện động, như bằng chứng từ hiện tượng pendelluft [12]. Giới hạn trên chính xác của
các giá trị chấp nhận được vẫn chưa được xác định. Tuy nhiên, các thử nghiệm gần đây đã nhắm mục tiêu các giá trị của ∆PLdyn nằm trong khoảng từ 15 đến 20 cmH2O [11, 13], nhưng cần nhiều nghiên cứu hơn để xác nhận ngưỡng này. Khi sử dụng bất kỳ phương pháp nào trong số các phương pháp này trong thực hành lâm sàng hàng ngày, nếu không thể đo tổng PEEP, thì PEEP đặt được sử dụng để tính
∆P.
Làm thế nào để kiểm soát áp lực đẩy ở những bệnh nhân thở tự nhiên?
Những bệnh nhân thở tự nhiên có động lực hô hấp thích hợp sẽ đáp ứng với những thay đổi về hỗ trợ áp lực, điều này có nghĩa là việc tăng hỗ trợ áp lực sẽ liên quan đến việc giảm đáng kể nỗ lực hít vào, dẫn đến kiểm soát ∆P tốt hơn. Tuy nhiên, việc kiểm soát ∆P ở những bệnh nhân có động lực hô hấp không phù hợp khó khăn hơn vì họ không đáp ứng với những thay đổi về hỗ trợ áp lực, duy trì cùng một nỗ lực hít vào bất kể sự gia tăng hỗ trợ áp lực và do đó tạo ra ∆P cao hơn. Một số bệnh nhân này có thể đáp ứng với mức PEEP tăng bằng cách ức chế nhu động hô hấp do phản xạ Hering-Breuer [13, 14]. Thúc đẩy kiềm hóa nhẹ và tăng FiO2 để đạt được mức PaO2 bình thường có thể hữu ích. Ngoài ra, một phân tích mô phỏng được thực hiện trong một nhóm bệnh nhân ARDS cho thấy việc loại bỏ carbon dioxide ngoài cơ thể cũng có thể giúp ích
[13] ở những bệnh nhân có tỷ lệ khoảng chết phế nang cao hơn hoặc Crs thấp hơn và những bệnh nhân được điều trị bằng cách chiết xuất CO2 cao hơn [15]. Tuy nhiên, giả thuyết này cần được kiểm tra trong các thử nghiệm trong tương lai.
Cuối cùng, nếu không có biện pháp nào trong số này có hiệu quả, người ta có thể phải cho bệnh nhân dùng thuốc an thần. Trong trường hợp này, thuốc an thần tác dụng ngắn có thể là lựa chọn ưu tiên. Cuối cùng, nếu không thể hạn chế ∆P bằng các chiến lược này, thì việc phong bế thần kinh cơ một phần cũng có thể tạo điều kiện cho thông khí bảo vệ phổi ở những bệnh nhân được an thần, làm giảm ∆PL và công thở [13, 16].
Hạn chế
Về mặt đánh giá nguy cơ mắc VILI, theo quan điểm sinh lý, chúng ta nên đo ∆PL. Tuy nhiên, chúng tôi đo ∆P thường xuyên hơn vì dễ thực hiện hơn ở bên giường bệnh. Hơn nữa, kết quả của một nghiên cứu quan sát lớn gần đây bao gồm những bệnh nhân mắc ARDS cho thấy ∆PL không cải thiện dự đoán tử vong trong 60 ngày so với ∆P [17]. Kết quả này cho thấy áp lực đẩy thành ngực cũng có thể liên quan đến mức độ nghiêm trọng và kết quả của bệnh. Theo quan điểm thực tế, giả sử rằng độ đàn hồi của thành ngực không thay đổi đáng kể trong quá trình nhập viện tại khoa chăm sóc đặc biệt, thì sự khác biệt về ∆P có thể phản ánh những thay đổi về ∆PL.
Tóm lại, ∆P có thể là biến số đơn lẻ mạnh mẽ nhất liên quan đến tử vong ở những bệnh nhân mắc ARDS vì nó xem xét cả mức độ nghiêm trọng của bệnh và cài đặt máy thở. Trong kỷ nguyên y học cá nhân hóa, một kích thước Vt duy nhất không phù hợp với tất cả. Áp lực đẩy có thể giúp hiệu chỉnh Vt theo kích thước của phổi và có khả năng cải thiện kết quả. Tuy nhiên, cách tiếp cận này cần được thử nghiệm trong các thử nghiệm ngẫu nhiên được thiết kế cụ thể.
Để lại một bình luận