CÁC KHẢO SÁT DỰA TRÊN NỀN TẢNG CỦA SIÊU ÂM: SIÊU ÂM GREY-SCALE, SIÊU ÂM DOPPLER, SIÊU ÂM BƠM NƯỚC BUỒNG TỬ CUNG, SIÊU ÂM 4D VÀ SIÊU ÂM ĐÀN HỒI MÔ
Siêu âm là phương tiện khảo sát hình ảnh chủ lực trong khảo sát, đánh giá các bệnh lý lành tính của tử cung.
Hình ảnh điển hình của u xơ-cơ tử cung trên siêu âm thang xám là ổ hồi âm kém hoặc không đồng nhất, có giảm âm phía sau, giới hạn rõ, phân biệt rõ với mô chung quanh.
Đối với u xơ-cơ tử cung, siêu âm thang xám (grey-scale) có giá trị chẩn đoán rất cao, với độ nhạy 95-100%.
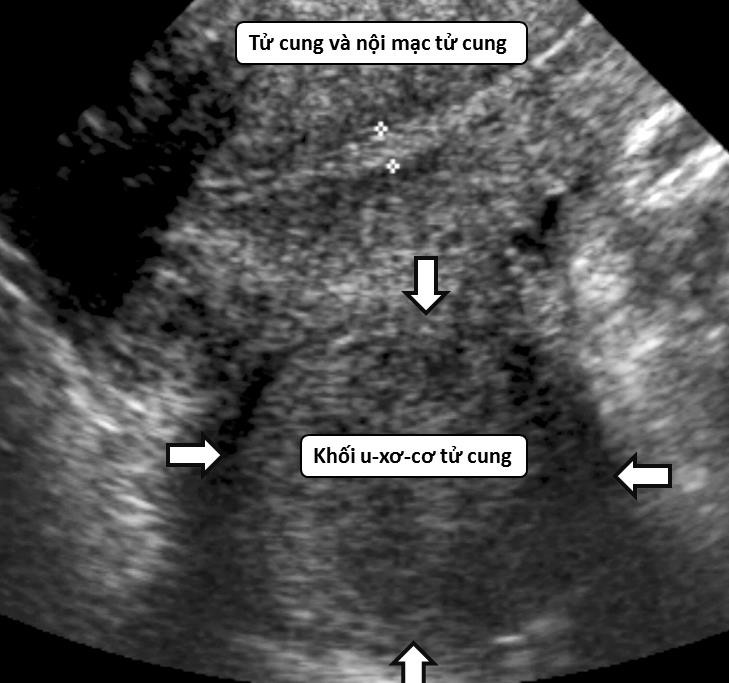
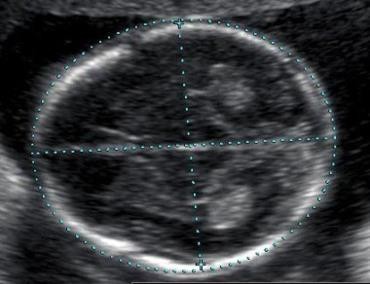
Hình 1: U xơ-cơ tử cung trên siêu âm thang xám
U xơ-cơ tử cung thể hiện bằng hình ảnh một khối phản âm kém, có giới hạn rõ. Độ hồi âm độ không giống với độ hồi âm của tử cung, có bóng giảm âm phía sau.
Nguồn: jultrasoundmed.org
Một hình ảnh điển hình của u xơ-cơ tử cung trên siêu âm thang xám giúp nghĩ đến u xơ-cơ tử cung.
Do độ nhạy rất cao và hình ảnh điển hình, nên việc thiết lập và xác định chẩn đoán u xơ-cơ tử cung hầu như chỉ căn cứ vào siêu âm thang xám. Nó có thể cung cấp hầu hết các thông tin cần thiết cho thiết lập chẩn đoán u xơ-cơ tử cung.
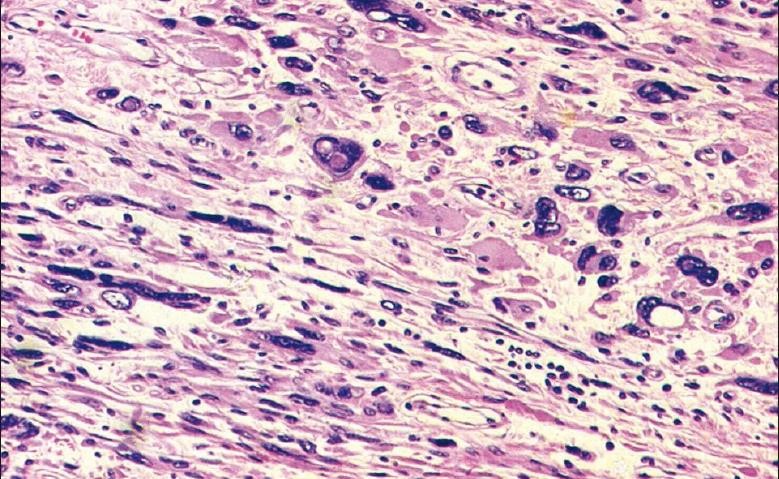
Trong u xơ-cơ tử cung, chẩn đoán phân biệt khó khăn nhất về mặt hình ảnh học khi sử dụng siêu âm thang xám là với adenomyosis và với leiomyosarcoma.
Trên siêu âm thang xám, adenomyosis có tính chất âm học tương tự u xơ-cơ tử cung.
| Mục tiêu bài giảng |
Sau khi học xong, sinh viên có khả năng:
- Nhận diện được u xơ-cơ tử cung trên các khảo sát hình ảnh dựa trên nền tảng siêu âm
- Nhận diện được adenomyosis trên các khảo sát hình ảnh dựa trên nền tảng siêu âm
- Trình bày được vai trò của cộng hưởng từ chẩn đoán u xơ-cơ tử cung và adenomyosis
|
Mục tiêu của khảo sát hình ảnh trong bệnh lý lành tính của tử cung là
- Xác định bản chất khối u
- Số lượng, kích thước, vị trí của các khối u (bản đồ u)
- Tương quan và ảnh hưởng của u đến cấu trúc lân cận
|
|
Cấu trúc âm của adenomyosis kém đồng nhất, giới hạn không rõ. Do cấu trúc kém đồng nhất, nên vùng giảm âm phía sau có dạng sọc dưa.
Trên siêu âm thang xám, leiomyosarcoma có các tính chất âm học hầu như không thể phân biệt với u xơ-cơ tử cung.
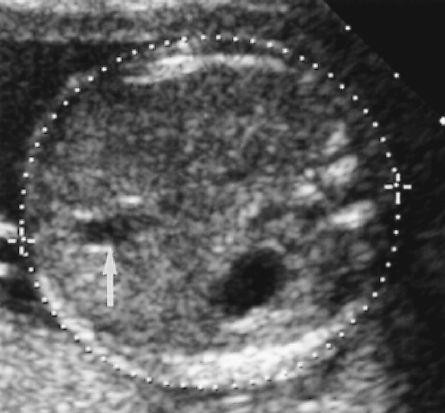
Hình 2: Adenomyosis trên siêu âm thang xám
Khối phản âm kém không thuần nhất, giới hạn không rõ, với phản âm kém phía sau hình sọc dưa
Nguồn: pinterest.com
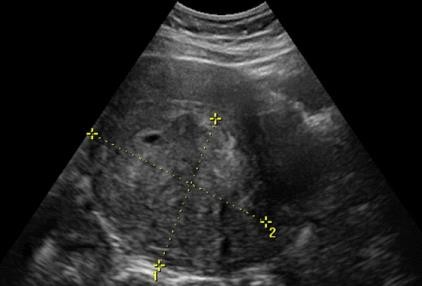
Hình 3: Leiomyosarcoma trên siêu âm thang xám
Khối phản âm kém không thuần nhất, hầu như có tất cả các đặc tính âm học của u xơ-cơ tử cung.
Nguồn: omicsgroup.org
Như vậy, một hình ảnh không điển hình buộc phải tìm cách để phân biệt và loại trừ với các khả năng khác.
Trong trường hợp siêu âm thang xám cho hình ảnh “không giống như hình ảnh điển hình”, thì khai thác cẩn thận bệnh sử, tiền sử là biện pháp có ích để thực hiện phân biệt này.
Siêu âm khảo sát dòng chảy bằng Doppler cung cấp những chi tiết giúp phân biệt trong trường hợp gặp khó khăn.
U xơ-cơ tử cung được cấp máu bằng mạch máu quanh u.
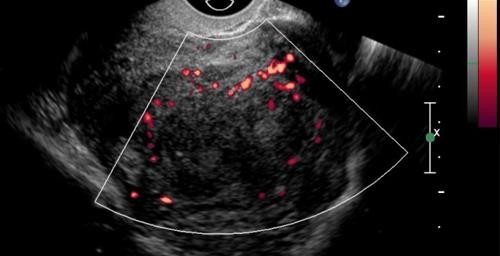
Hình 4: U xơ-cơ tử cung trên siêu âm Doppler
Khối phản âm kém khá thuần nhất, mạch máu ít, phân bố ở ngoại vi u.
Nguồn: iame.com
Ngược lại, trong adenomyosis, hình ảnh mạch máu có thể thấy bên trong lòng khối u.
Hình 5: Adenomyosis trên siêu âm Doppler
Trong adenomyosis, phân bố mạch máu dồi dào, phân bố khắp khối u.
Nguồn: abdel-gadir.com
Khảo sát adenomyosis bằng Doppler có giá trị rất cao, tương đương với cộng hưởng từ.
Các đặc tính trên Doppler của adenomyosis cho phép phân biệt bệnh lý này với u xơ-cơ tử cung, với giá trị rất cao, gần như tương đương với cộng hưởng từ.
Khảo sát adenomyosis bằng Doppler lệ thuộc nhiều vào kinh nghiệm người đọc siêu âm, trong khi đó, cộng hưởng từ không lệ thuộc người đọc.
Siêu âm Doppler cũng có thể khảo sát được vùng kết nối (JZ) nhưng không rõ như cộng hưởng từ.
Siêu âm với bơm nước lòng tử cung (SIS) đặc biệt có giá trị trong khảo sát các u xơ-cơ tử cung dưới niêm mạc.
Trong các u xơ-cơ dưới niêm mạc, phân loại vị trí có vai trò quan trọng trong quyết định cách can thiệp.
U xơ-cơ tử cung dưới niêm mạc loại FIGO 0-1 là chỉ định rất tốt của các can thiệp qua soi buồng tử cung, trong khi đó, can thiệp qua soi buồng tử cung cho các u xơ-cơ tử cung loại FIGO 2 sẽ khó khăn hơn.
SIS giúp đánh giá tỉ lệ (%) của khối u nhô vào trong buồng tử cung, từ đó cho phân loại FIGO chính xác vị trí u.
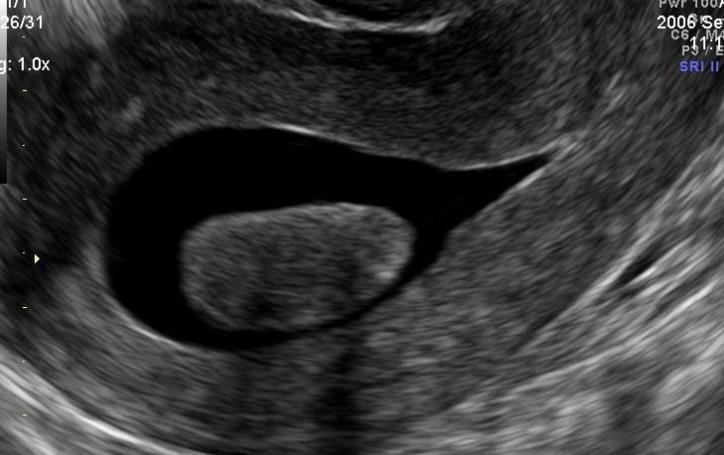
Hình 6: U xơ-cơ tử cung FIGO 0 qua SIS. U nằm hẳn trong lòng tử cung
Nguồn: ultrasoundforwomenpenrith.com.au
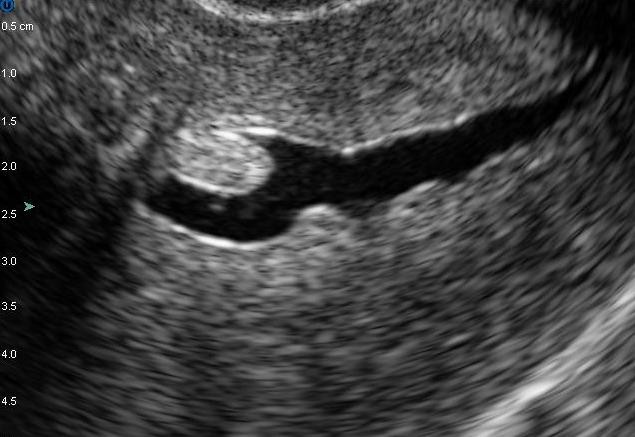
Hình 7: U xơ-cơ tử cung FIGO 1.
Trên 50% khối u ở trong lòng tử cung. Chỉ định can thiệp qua nội soi buồng tử cung là khả thi.
Nguồn: npvfertilitycenter.com
Khi có cấu trúc trong lòng tử cung trên SIS, cần phân biệt:
- Giữa u xơ-cơ tử cung FIGO 0 với polyps lòng tử cung
- Giữa polyps chân rộng với u xơ-cơ tử cung FIGO 1
Đôi khi các u xơ-cơ dưới niêm mạc có cuống (FIGO 0) có thể bị nhầm với polyp nội mạc tử cung, và ngược lại polyp nội mạc tử cung chân rộng sẽ dễ lầm với u xơ-cơ.
Do hai bệnh lý này có ý nghĩa cũng như cách xử lý khác nhau nên cần phải nhờ vào Doppler để phân định.
Trong u xơ-cơ dưới niêm mạc, Doppler cho thấy có hình ảnh tưới máu quanh u. Trong khi đó, do polyp nội mạc xuất phát hoàn toàn từ nội mạc, nên chỉ có một mạch máu duy nhất đi vào trung tâm của polyp.
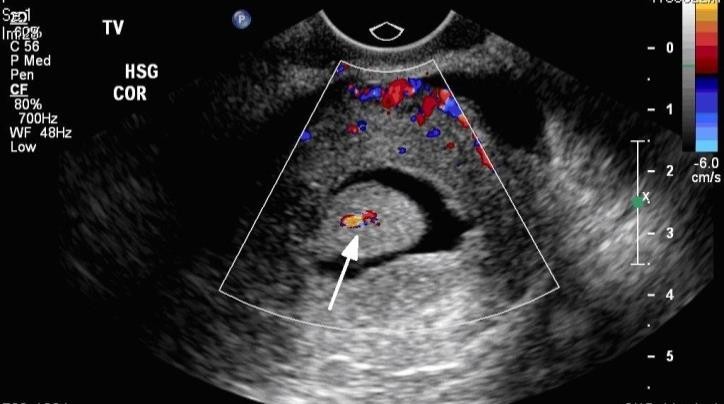
Hình 8: Phân biệt polyp và u xơ-cơ tử cung FIGO 1 bằng Doppler
Một mạch máu duy nhất đi thẳng từ nội mạc vào trung tâm của polyp.
Nguồn: dbwmpns0f8ewg.cloudfront.net
Gần đây, có hai phương tiện hình ảnh khảo sát khác, cũng dựa trên nền tảng siêu âm, đã được dùng cho mục đích nhận diện và phân biệt adenomyosis: siêu âm 4D và siêu âm đàn hối.
Siêu âm 4D “nhập khẩu” khái niệm JZ từ MRI, đồng thời có thể giúp xây dựng bản đồ tổn thương.
So với siêu âm grey-scale hay siêu âm Doppler, siêu âm 4D có 2 ưu thế quan trọng:
Khả năng xây dựng hình ảnh 3 chiều động làm cho việc lập bản đồ tổn thương dễ dàng hơn.
Độ phân giải hình ảnh cao, cho phép “nhập khẩu” khái niệm khảo sát vùng kết nối (JZ).
Hai ưu thế này của siêu âm 4D giúp cho phương tiện này nhanh chóng có được vị trí quan trọng trong khảo sát các cấu trúc lành tính của tử cung.
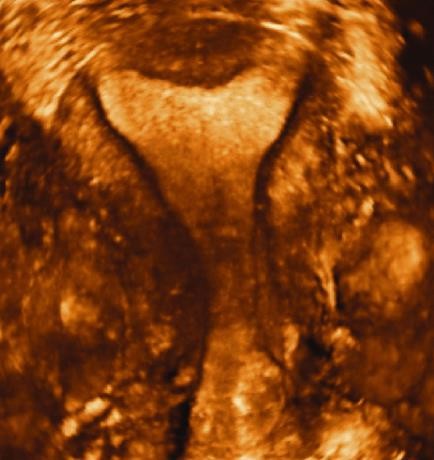
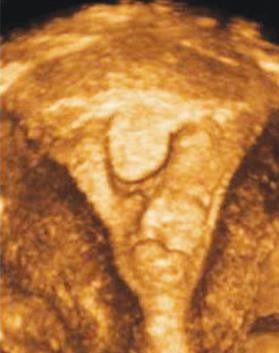
Hình 9: Các ưu thế của siêu âm 4D
Hình 9a (trái) cho phép nhận diện được JZ (đường viện tối màu quanh nội mạc tử cung.
Hình 9b (phải) cho phép thiết lập bản đồ phân bố của các cấu trúc cần khảo sát.
Nguồn: accessObGyn. McGraw-Hill Medical
Báo cáo ban đầu cho thấy tính giá trị rất cao (Se, Sp, NPV, PPV) của siêu âm đàn hồi trong nhận diện adenomyosis.
Siêu âm đàn hồi giúp khảo sát mức độ đàn hồi mô. Trước đây, khảo sát này đã được ứng dụng cho khảo sát các khối u khác như u gan…
U xơ-cơ tử cung được cấu tạo chỉ bằng mô cơ-sợi. Adenomyosis được cấu tạo từ các tổ chức tuyến nội mạc tử cung lạc vị nằm trong lớp cơ, kèm theo là cấu trúc sợi cơ tăng dưỡng và tăng sản.
Tính cứng, kém đàn hồi là các đặc tính quan trọng của adenomyosis.
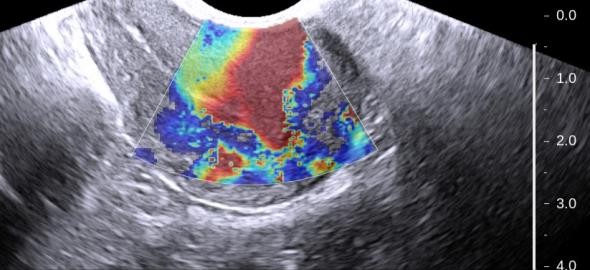
Hình 10: Siêu âm đàn hồi mô cho adenomyosis
Cấu trúc adenomyosis là các cấu trúc cứng, kém đàn hồi (đỏ).
Các vùng có độ đàn hồi cao là các vùng cơ tử cung có cấu trúc mô học bình thường.
Nguồn: ultrasoundimaging.blogspot.com
Do đặc điểm cấu tạo này mà adenomyosis không đàn hồi như mô tử cung, cũng như có độ cứng và độ đàn hồi khác với các u xơ-cơ tử cung.
Siêu âm khảo sát đàn hồi mô sẽ giúp nhận diện và phân biệt các cấu trúc này.
CỘNG HƯỞNG TỪ (MRI)
Không vượt trội hơn siêu âm trong tuyệt đại đa số các chỉ định khảo sát thông thường, thành giá cao và không sẵn có là các nhược điểm của MRI.
Một cách tổng quát, so với siêu âm, MRI có ưu thế là một phương pháp không lệ thuộc người đọc, đồng thời có thể cung cấp được chi tiết bản đồ tổn thương.
Điểm mạnh nhất của MRI so với siêu âm trong khảo sát các bệnh lý lành tính của thân tử cung là khả năng phân biệt giữa adenomyosis với u xơ-cơ tử cung.
MRI phân biệt được hai bệnh lý này là nhờ vào khảo sát vùng kết nối (JZ) và đặc tính cấu trúc mô học khác biệt giữa adenomyosis với u xơ-cơ tử cung.
Cấu trúc của u xơ-cơ tử cung là mô cơ sợi, thuần nhất, trong khi cấu trúc của adenomyosis là mô tuyến nội mạc, vì thế sẽ có hình ảnh các thành phần cấu trúc khác nhau.
Siêu âm có thể không phân định được giữa u xơ-cơ tử cung và adenomyosis trong trường hợp u xơ-cơ tử cung có thoái hóa, do cấu trúc trở nên không đồng nhất. Trong các tình huống này, MRI sẽ là một phương pháp hữu hiệu để giúp thực hiện chẩn đoán phân biệt.
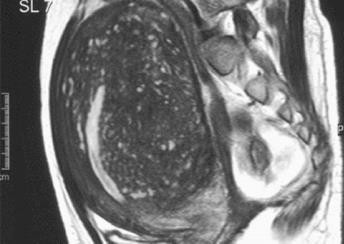
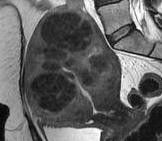
Hình 11: Hình ảnh MRI của adenomyosis (trái) và u xơ-cơ tử cung (phải). Trong adenomyosis, trên T2W, các ổ xuất huyết nhỏ thể hiện bằng các điểm tăng tín hiệu.
Các u xơ-cơ tử cung có biểu hiện trên MRI như các vùng có tín hiệu kém.
Nguồn: keyword-suggestions.com
Adenomyosis thể hiện trên MRI với các điểm tăng tín hiệu trên T2W, hoặc các vùng khuyết, khác hẳn với cấu trúc tín hiệu của cơ tử cung bình thường.
JZ dầy là đặc trưng của adenomyosis. Bình thường, độ dầy của JZ không vượt quá 40% độ dầy của thành tử cung. JZ dầy trên 40% là một dấu hiệu gợi ý của adenomyosis.
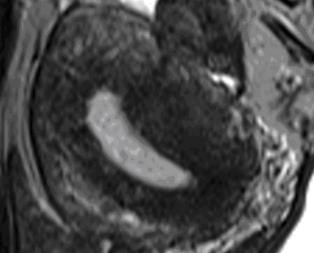
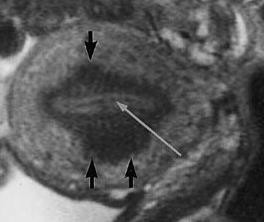
Hình 12: Junctional Zone (JZ) trong adenomyosis
JZ thể hiện trên T2W là vùng tín hiệu kém nằm giữa nội mạc tử cung chức năng có tín hiệu mạnh và cơ tử cung có tín hiệu yếu.
Nguồn: Bộ môn Phụ Sản ĐH Y Dược TP HCM
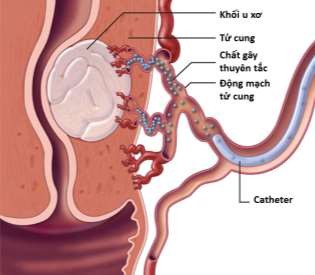
Nhờ thiết lập được bản đồ tổn thương, MRI còn dùng để lên kế hoạch điều trị cho những trường hợp phức tạp, hoặc trước khi làm thuyên tắc động mạch tử cung.
Việc thiết lập bản đồ tổn thương có ý nghĩa lớn trong trường hợp có quá nhiều tổn thương, hay cần xác định một cách rõ ràng ảnh hưởng của tổn thương trên hình thái buồng tử cung và chức năng nội mạc.
Khi đó, thiết lập bản đồ tổn thương là nột thành tố quan trọng giúp hoạch định chiến lược can thiệp.
Trên siêu âm Doppler, có thể nhận diện được JZ, nhưng khả năng phân biệt JZ không cao và không rõ ràng.
Khả năng phân biệt này được cải thiện qua siêu âm 4D.
Phân biệt với leiomyosarcoma cũng là chỉ định của MRI.
Phân định leiomyosarcoma và u xơ-cơ tử cung là rất khó khăn bằng cách phương tiện khảo sát hình ảnh thông
thường. Chúng chỉ khác nhau về tế bào. Dị biệt về tính chất tế bào tạo ra các dị biệt về đậm độ tín hiệu trên MRI.
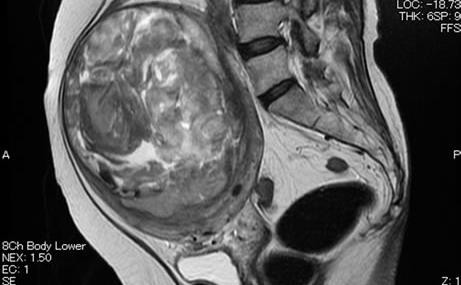
Hình 13: Leiomyosarcoma trên MRI
Hình ảnh dị thường của khối u tạo ra do đậm độ tín hiệu rất dị biệt, đến từ sự dị biệt của đậm độ proton của thành phần u.
Nguồn: file.scirp.org
1. Obstetrics and gynecology 8th edition. Tác giả Beckmann. Hợp tác xuất bản với ACOG. Nhà xuất bản Wolters Kluwer Health 2018
TÀI LIỆU THAM KHẢO CHÍNH
1. Comprehensive gynecology 7th edition. Tác giả Lobo RA. Nhà xuất bản Elsevier 2017.
Vai trò của hình ảnh học trong các bệnh lý lành tính ở tử cung
Âu Nhựt Luân
CÁC KHẢO SÁT DỰA TRÊN NỀN TẢNG CỦA SIÊU ÂM: SIÊU ÂM GREY-SCALE, SIÊU ÂM DOPPLER, SIÊU ÂM BƠM NƯỚC BUỒNG TỬ CUNG, SIÊU ÂM 4D VÀ SIÊU ÂM ĐÀN HỒI MÔ
Siêu âm là phương tiện khảo sát hình ảnh chủ lực trong khảo sát, đánh giá các bệnh lý lành tính của tử cung.
Hình ảnh điển hình của u xơ-cơ tử cung trên siêu âm thang xám là ổ hồi âm kém hoặc không đồng nhất, có giảm âm phía sau, giới hạn rõ, phân biệt rõ với mô chung quanh.
Đối với u xơ-cơ tử cung, siêu âm thang xám (grey-scale) có giá trị chẩn đoán rất cao, với độ nhạy 95-100%.
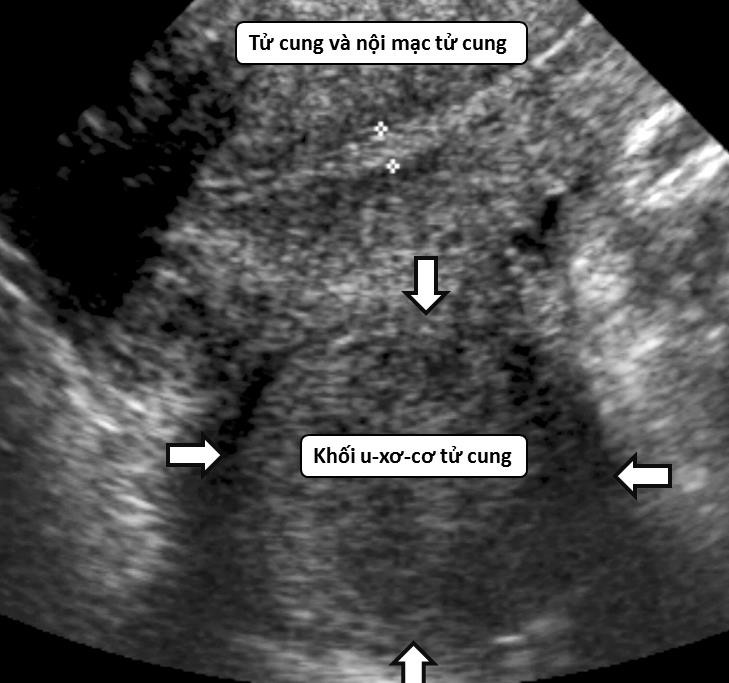
Hình 1: U xơ-cơ tử cung trên siêu âm thang xám
U xơ-cơ tử cung thể hiện bằng hình ảnh một khối phản âm kém, có giới hạn rõ. Độ hồi âm độ không giống với độ hồi âm của tử cung, có bóng giảm âm phía sau.
Nguồn: jultrasoundmed.org
Một hình ảnh điển hình của u xơ-cơ tử cung trên siêu âm thang xám giúp nghĩ đến u xơ-cơ tử cung.
Do độ nhạy rất cao và hình ảnh điển hình, nên việc thiết lập và xác định chẩn đoán u xơ-cơ tử cung hầu như chỉ căn cứ vào siêu âm thang xám. Nó có thể cung cấp hầu hết các thông tin cần thiết cho thiết lập chẩn đoán u xơ-cơ tử cung.
Trong u xơ-cơ tử cung, chẩn đoán phân biệt khó khăn nhất về mặt hình ảnh học khi sử dụng siêu âm thang xám là với adenomyosis và với leiomyosarcoma.
Trên siêu âm thang xám, adenomyosis có tính chất âm học tương tự u xơ-cơ tử cung.
| Mục tiêu bài giảng |
Sau khi học xong, sinh viên có khả năng:
- Nhận diện được u xơ-cơ tử cung trên các khảo sát hình ảnh dựa trên nền tảng siêu âm
- Nhận diện được adenomyosis trên các khảo sát hình ảnh dựa trên nền tảng siêu âm
- Trình bày được vai trò của cộng hưởng từ chẩn đoán u xơ-cơ tử cung và adenomyosis
|
Mục tiêu của khảo sát hình ảnh trong bệnh lý lành tính của tử cung là
- Xác định bản chất khối u
- Số lượng, kích thước, vị trí của các khối u (bản đồ u)
- Tương quan và ảnh hưởng của u đến cấu trúc lân cận
|
|
Cấu trúc âm của adenomyosis kém đồng nhất, giới hạn không rõ. Do cấu trúc kém đồng nhất, nên vùng giảm âm phía sau có dạng sọc dưa.
Trên siêu âm thang xám, leiomyosarcoma có các tính chất âm học hầu như không thể phân biệt với u xơ-cơ tử cung.
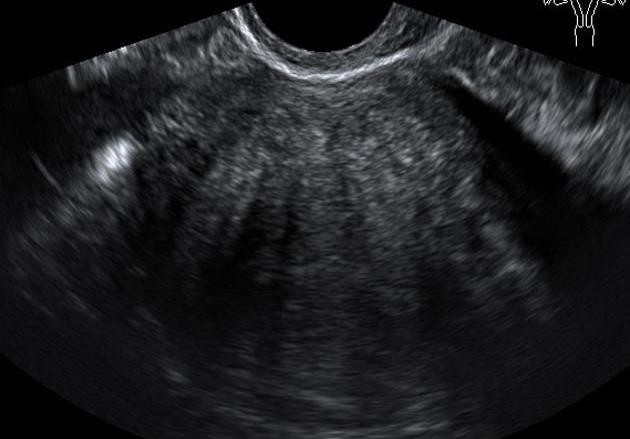
Hình 2: Adenomyosis trên siêu âm thang xám
Khối phản âm kém không thuần nhất, giới hạn không rõ, với phản âm kém phía sau hình sọc dưa
Nguồn: pinterest.com
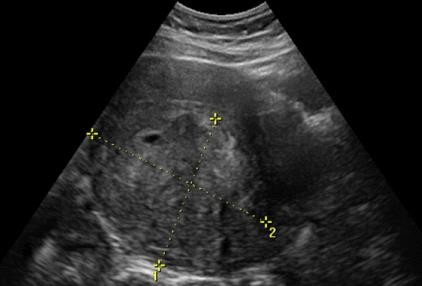
Hình 3: Leiomyosarcoma trên siêu âm thang xám
Khối phản âm kém không thuần nhất, hầu như có tất cả các đặc tính âm học của u xơ-cơ tử cung.
Nguồn: omicsgroup.org
Như vậy, một hình ảnh không điển hình buộc phải tìm cách để phân biệt và loại trừ với các khả năng khác.
Trong trường hợp siêu âm thang xám cho hình ảnh “không giống như hình ảnh điển hình”, thì khai thác cẩn thận bệnh sử, tiền sử là biện pháp có ích để thực hiện phân biệt này.
Siêu âm khảo sát dòng chảy bằng Doppler cung cấp những chi tiết giúp phân biệt trong trường hợp gặp khó khăn.
U xơ-cơ tử cung được cấp máu bằng mạch máu quanh u.
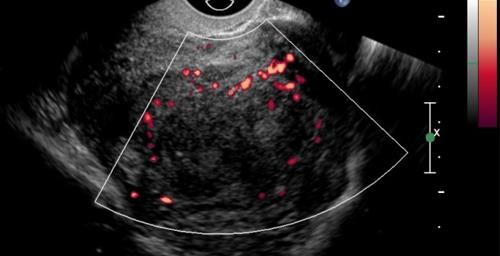
Hình 4: U xơ-cơ tử cung trên siêu âm Doppler
Khối phản âm kém khá thuần nhất, mạch máu ít, phân bố ở ngoại vi u.
Nguồn: iame.com
Ngược lại, trong adenomyosis, hình ảnh mạch máu có thể thấy bên trong lòng khối u.
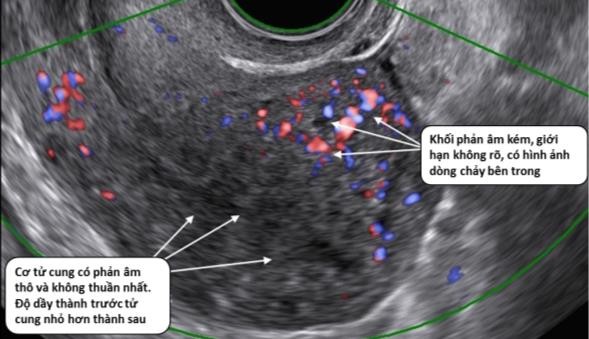
Hình 5: Adenomyosis trên siêu âm Doppler
Trong adenomyosis, phân bố mạch máu dồi dào, phân bố khắp khối u.
Nguồn: abdel-gadir.com
Khảo sát adenomyosis bằng Doppler có giá trị rất cao, tương đương với cộng hưởng từ.
Các đặc tính trên Doppler của adenomyosis cho phép phân biệt bệnh lý này với u xơ-cơ tử cung, với giá trị rất cao, gần như tương đương với cộng hưởng từ.
Khảo sát adenomyosis bằng Doppler lệ thuộc nhiều vào kinh nghiệm người đọc siêu âm, trong khi đó, cộng hưởng từ không lệ thuộc người đọc.
Siêu âm Doppler cũng có thể khảo sát được vùng kết nối (JZ) nhưng không rõ như cộng hưởng từ.
Siêu âm với bơm nước lòng tử cung (SIS) đặc biệt có giá trị trong khảo sát các u xơ-cơ tử cung dưới niêm mạc.
Trong các u xơ-cơ dưới niêm mạc, phân loại vị trí có vai trò quan trọng trong quyết định cách can thiệp.
U xơ-cơ tử cung dưới niêm mạc loại FIGO 0-1 là chỉ định rất tốt của các can thiệp qua soi buồng tử cung, trong khi đó, can thiệp qua soi buồng tử cung cho các u xơ-cơ tử cung loại FIGO 2 sẽ khó khăn hơn.
SIS giúp đánh giá tỉ lệ (%) của khối u nhô vào trong buồng tử cung, từ đó cho phân loại FIGO chính xác vị trí u.
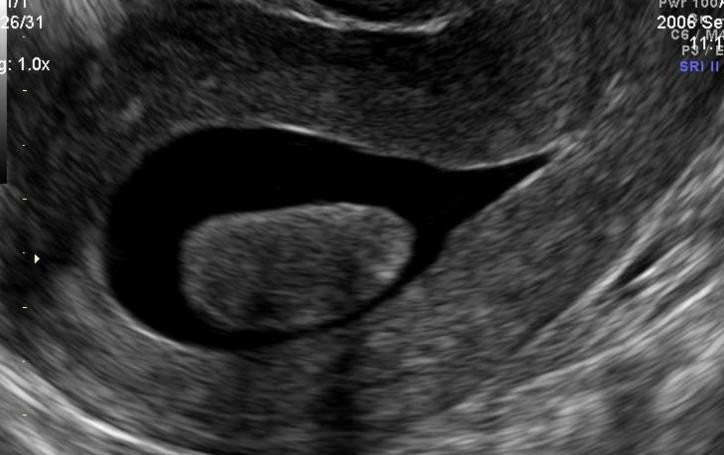
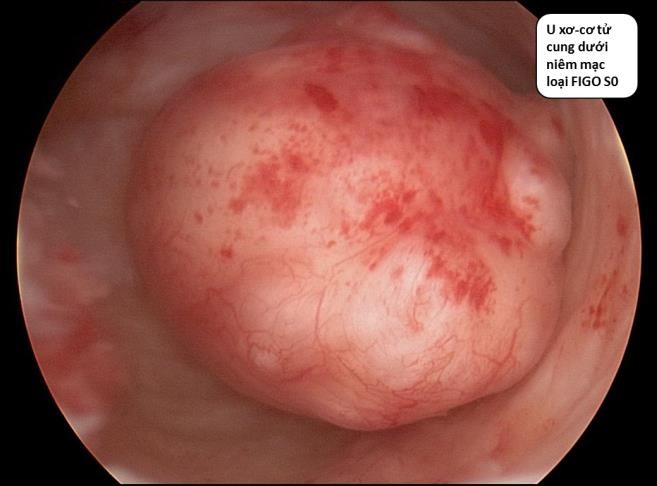
Hình 6: U xơ-cơ tử cung FIGO 0 qua SIS. U nằm hẳn trong lòng tử cung
Nguồn: ultrasoundforwomenpenrith.com.au
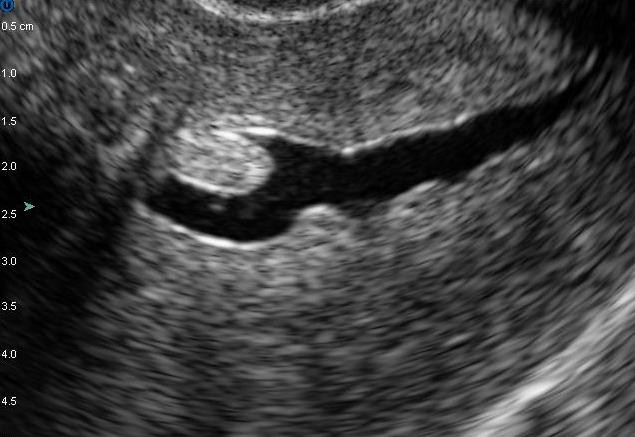
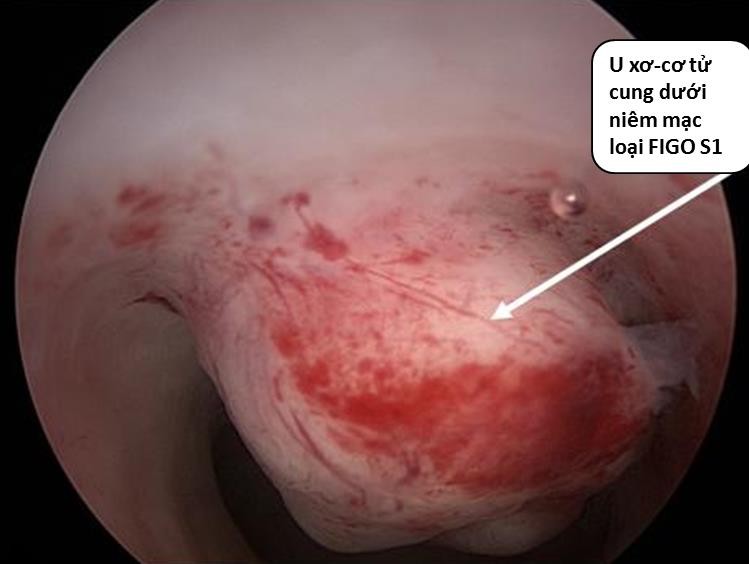
Hình 7: U xơ-cơ tử cung FIGO 1.
Trên 50% khối u ở trong lòng tử cung. Chỉ định can thiệp qua nội soi buồng tử cung là khả thi.
Nguồn: npvfertilitycenter.com
Khi có cấu trúc trong lòng tử cung trên SIS, cần phân biệt:
- Giữa u xơ-cơ tử cung FIGO 0 với polyps lòng tử cung
- Giữa polyps chân rộng với u xơ-cơ tử cung FIGO 1
Đôi khi các u xơ-cơ dưới niêm mạc có cuống (FIGO 0) có thể bị nhầm với polyp nội mạc tử cung, và ngược lại polyp nội mạc tử cung chân rộng sẽ dễ lầm với u xơ-cơ.
Do hai bệnh lý này có ý nghĩa cũng như cách xử lý khác nhau nên cần phải nhờ vào Doppler để phân định.
Trong u xơ-cơ dưới niêm mạc, Doppler cho thấy có hình ảnh tưới máu quanh u. Trong khi đó, do polyp nội mạc xuất phát hoàn toàn từ nội mạc, nên chỉ có một mạch máu duy nhất đi vào trung tâm của polyp.
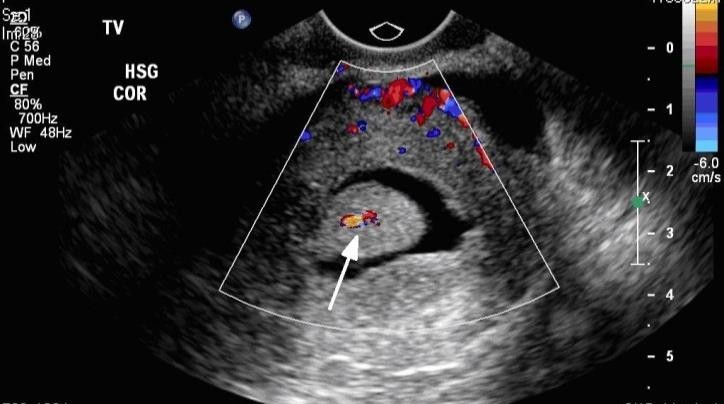
Hình 8: Phân biệt polyp và u xơ-cơ tử cung FIGO 1 bằng Doppler
Một mạch máu duy nhất đi thẳng từ nội mạc vào trung tâm của polyp.
Nguồn: dbwmpns0f8ewg.cloudfront.net
Gần đây, có hai phương tiện hình ảnh khảo sát khác, cũng dựa trên nền tảng siêu âm, đã được dùng cho mục đích nhận diện và phân biệt adenomyosis: siêu âm 4D và siêu âm đàn hối.
Siêu âm 4D “nhập khẩu” khái niệm JZ từ MRI, đồng thời có thể giúp xây dựng bản đồ tổn thương.
So với siêu âm grey-scale hay siêu âm Doppler, siêu âm 4D có 2 ưu thế quan trọng:
Khả năng xây dựng hình ảnh 3 chiều động làm cho việc lập bản đồ tổn thương dễ dàng hơn.
Độ phân giải hình ảnh cao, cho phép “nhập khẩu” khái niệm khảo sát vùng kết nối (JZ).
Hai ưu thế này của siêu âm 4D giúp cho phương tiện này nhanh chóng có được vị trí quan trọng trong khảo sát các cấu trúc lành tính của tử cung.
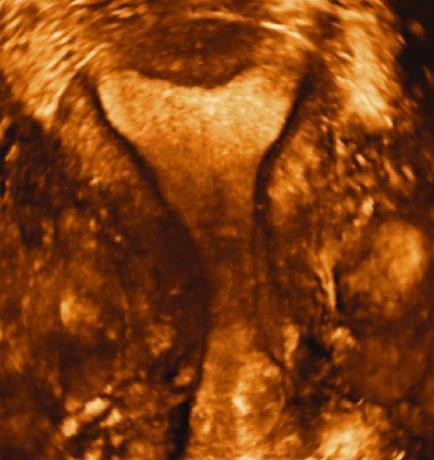
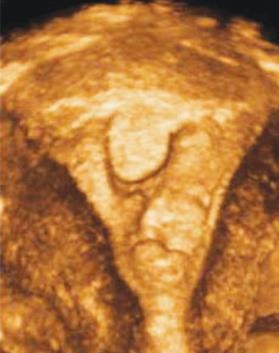
Hình 9: Các ưu thế của siêu âm 4D
Hình 9a (trái) cho phép nhận diện được JZ (đường viện tối màu quanh nội mạc tử cung.
Hình 9b (phải) cho phép thiết lập bản đồ phân bố của các cấu trúc cần khảo sát.
Nguồn: accessObGyn. McGraw-Hill Medical
Báo cáo ban đầu cho thấy tính giá trị rất cao (Se, Sp, NPV, PPV) của siêu âm đàn hồi trong nhận diện adenomyosis.
Siêu âm đàn hồi giúp khảo sát mức độ đàn hồi mô. Trước đây, khảo sát này đã được ứng dụng cho khảo sát các khối u khác như u gan…
U xơ-cơ tử cung được cấu tạo chỉ bằng mô cơ-sợi. Adenomyosis được cấu tạo từ các tổ chức tuyến nội mạc tử cung lạc vị nằm trong lớp cơ, kèm theo là cấu trúc sợi cơ tăng dưỡng và tăng sản.
Tính cứng, kém đàn hồi là các đặc tính quan trọng của adenomyosis.
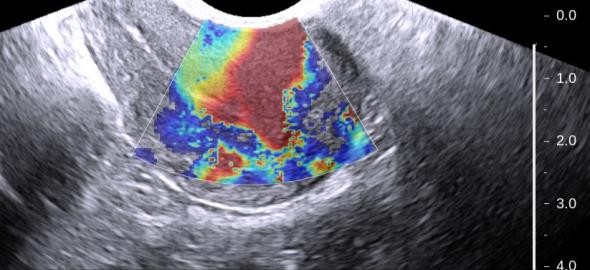
Hình 10: Siêu âm đàn hồi mô cho adenomyosis
Cấu trúc adenomyosis là các cấu trúc cứng, kém đàn hồi (đỏ).
Các vùng có độ đàn hồi cao là các vùng cơ tử cung có cấu trúc mô học bình thường.
Nguồn: ultrasoundimaging.blogspot.com
Do đặc điểm cấu tạo này mà adenomyosis không đàn hồi như mô tử cung, cũng như có độ cứng và độ đàn hồi khác với các u xơ-cơ tử cung.
Siêu âm khảo sát đàn hồi mô sẽ giúp nhận diện và phân biệt các cấu trúc này.
CỘNG HƯỞNG TỪ (MRI)
Không vượt trội hơn siêu âm trong tuyệt đại đa số các chỉ định khảo sát thông thường, thành giá cao và không sẵn có là các nhược điểm của MRI.
Một cách tổng quát, so với siêu âm, MRI có ưu thế là một phương pháp không lệ thuộc người đọc, đồng thời có thể cung cấp được chi tiết bản đồ tổn thương.
Điểm mạnh nhất của MRI so với siêu âm trong khảo sát các bệnh lý lành tính của thân tử cung là khả năng phân biệt giữa adenomyosis với u xơ-cơ tử cung.
MRI phân biệt được hai bệnh lý này là nhờ vào khảo sát vùng kết nối (JZ) và đặc tính cấu trúc mô học khác biệt giữa adenomyosis với u xơ-cơ tử cung.
Cấu trúc của u xơ-cơ tử cung là mô cơ sợi, thuần nhất, trong khi cấu trúc của adenomyosis là mô tuyến nội mạc, vì thế sẽ có hình ảnh các thành phần cấu trúc khác nhau.
Siêu âm có thể không phân định được giữa u xơ-cơ tử cung và adenomyosis trong trường hợp u xơ-cơ tử cung có thoái hóa, do cấu trúc trở nên không đồng nhất. Trong các tình huống này, MRI sẽ là một phương pháp hữu hiệu để giúp thực hiện chẩn đoán phân biệt.
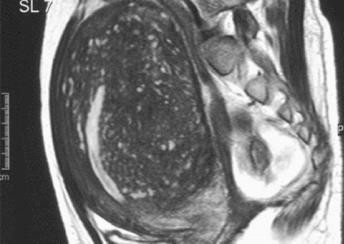
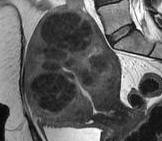
Hình 11: Hình ảnh MRI của adenomyosis (trái) và u xơ-cơ tử cung (phải). Trong adenomyosis, trên T2W, các ổ xuất huyết nhỏ thể hiện bằng các điểm tăng tín hiệu.
Các u xơ-cơ tử cung có biểu hiện trên MRI như các vùng có tín hiệu kém.
Nguồn: keyword-suggestions.com
Adenomyosis thể hiện trên MRI với các điểm tăng tín hiệu trên T2W, hoặc các vùng khuyết, khác hẳn với cấu trúc tín hiệu của cơ tử cung bình thường.
JZ dầy là đặc trưng của adenomyosis. Bình thường, độ dầy của JZ không vượt quá 40% độ dầy của thành tử cung. JZ dầy trên 40% là một dấu hiệu gợi ý của adenomyosis.
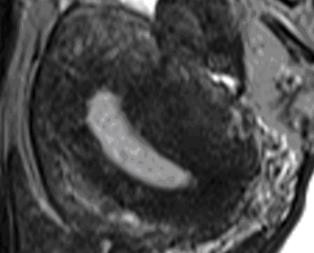
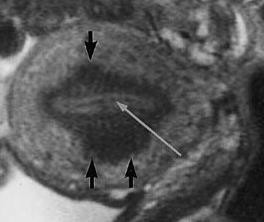
Hình 12: Junctional Zone (JZ) trong adenomyosis
JZ thể hiện trên T2W là vùng tín hiệu kém nằm giữa nội mạc tử cung chức năng có tín hiệu mạnh và cơ tử cung có tín hiệu yếu.
Nguồn: Bộ môn Phụ Sản ĐH Y Dược TP HCM
Nhờ thiết lập được bản đồ tổn thương, MRI còn dùng để lên kế hoạch điều trị cho những trường hợp phức tạp, hoặc trước khi làm thuyên tắc động mạch tử cung.
Việc thiết lập bản đồ tổn thương có ý nghĩa lớn trong trường hợp có quá nhiều tổn thương, hay cần xác định một cách rõ ràng ảnh hưởng của tổn thương trên hình thái buồng tử cung và chức năng nội mạc.
Khi đó, thiết lập bản đồ tổn thương là nột thành tố quan trọng giúp hoạch định chiến lược can thiệp.
Trên siêu âm Doppler, có thể nhận diện được JZ, nhưng khả năng phân biệt JZ không cao và không rõ ràng.
Khả năng phân biệt này được cải thiện qua siêu âm 4D.
Phân biệt với leiomyosarcoma cũng là chỉ định của MRI.
Phân định leiomyosarcoma và u xơ-cơ tử cung là rất khó khăn bằng cách phương tiện khảo sát hình ảnh thông
thường. Chúng chỉ khác nhau về tế bào. Dị biệt về tính chất tế bào tạo ra các dị biệt về đậm độ tín hiệu trên MRI.
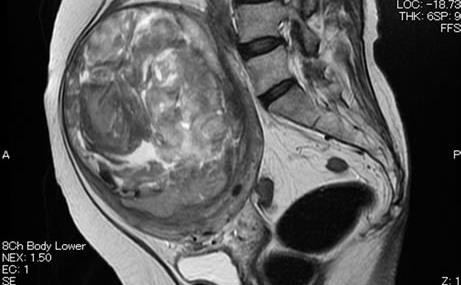
Hình 13: Leiomyosarcoma trên MRI
Hình ảnh dị thường của khối u tạo ra do đậm độ tín hiệu rất dị biệt, đến từ sự dị biệt của đậm độ proton của thành phần u.
Nguồn: file.scirp.org
1. Obstetrics and gynecology 8th edition. Tác giả Beckmann. Hợp tác xuất bản với ACOG. Nhà xuất bản Wolters Kluwer Health 2018
TÀI LIỆU THAM KHẢO CHÍNH
1. Comprehensive gynecology 7th edition. Tác giả Lobo RA. Nhà xuất bản Elsevier 2017.
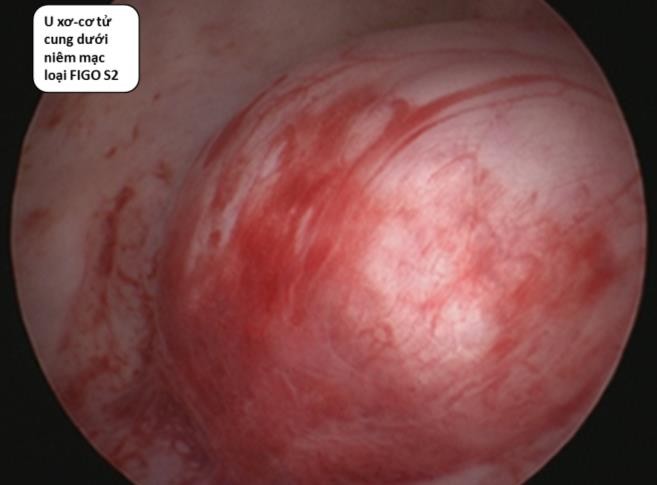
































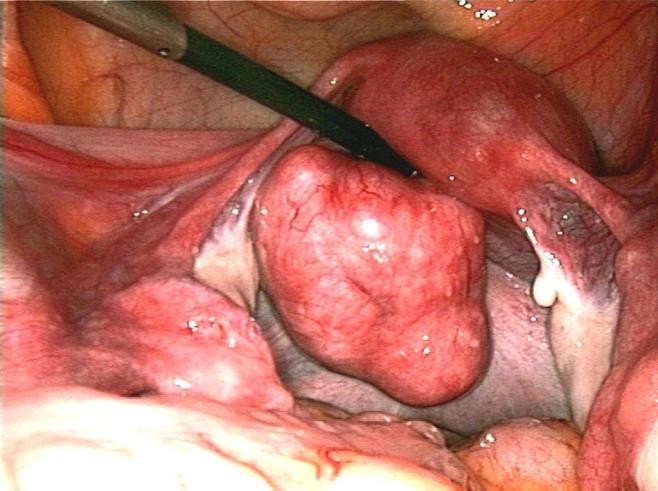
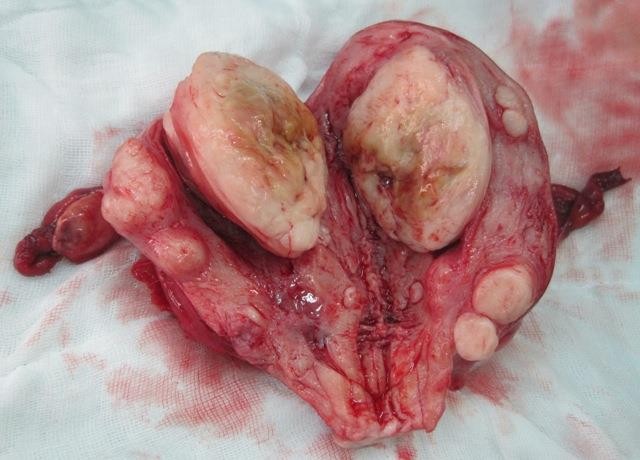
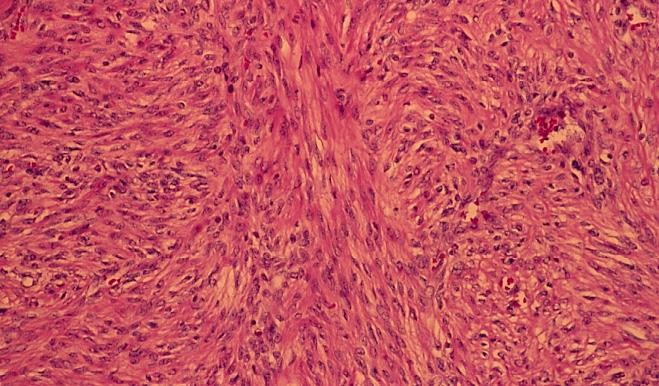
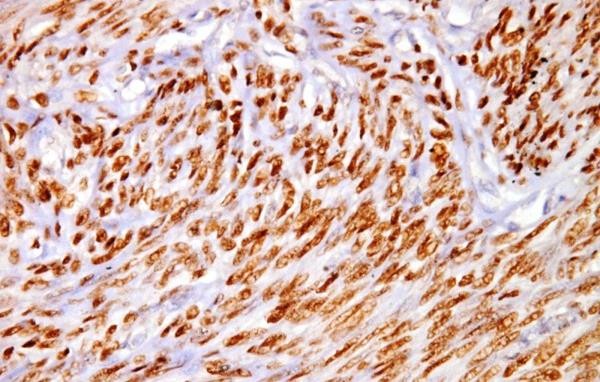
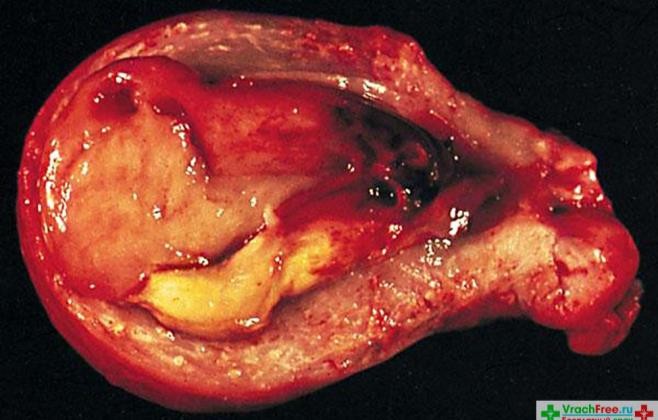
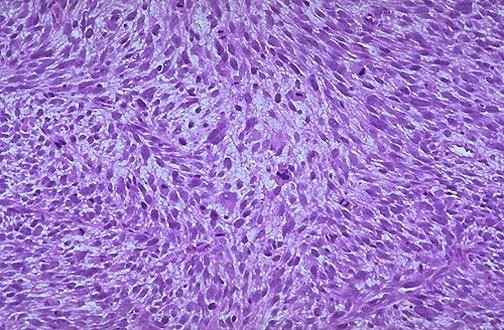

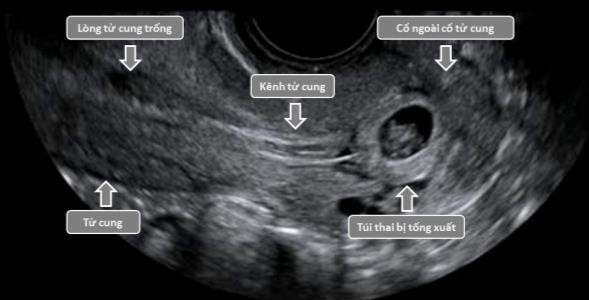
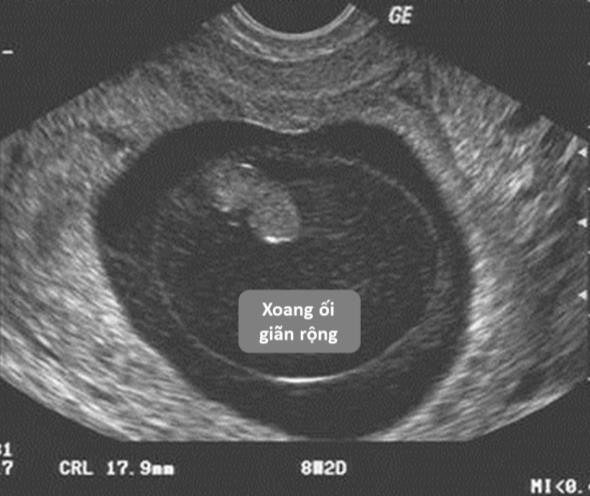
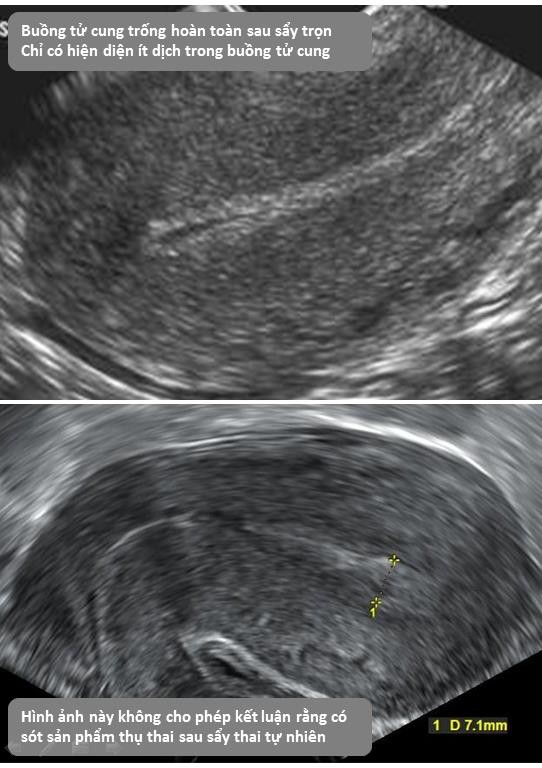
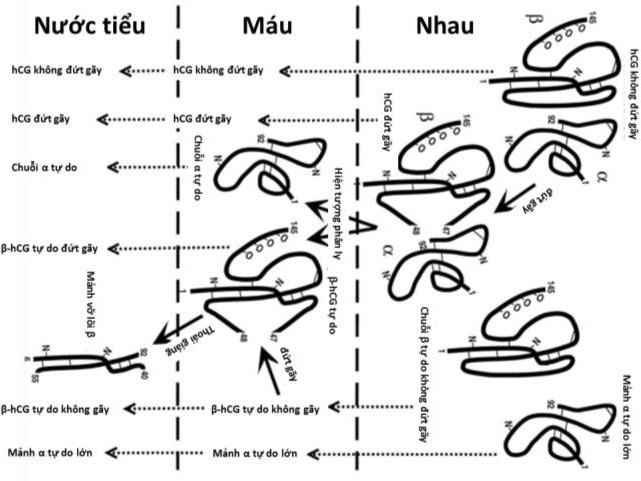
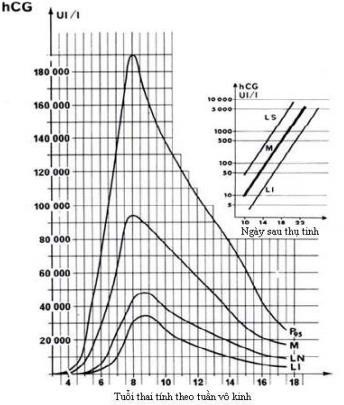
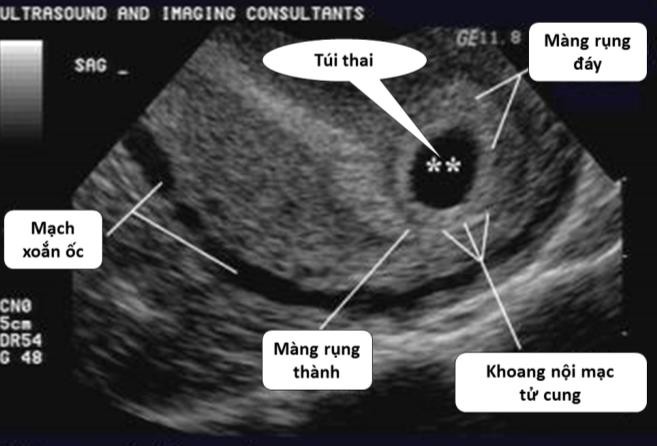
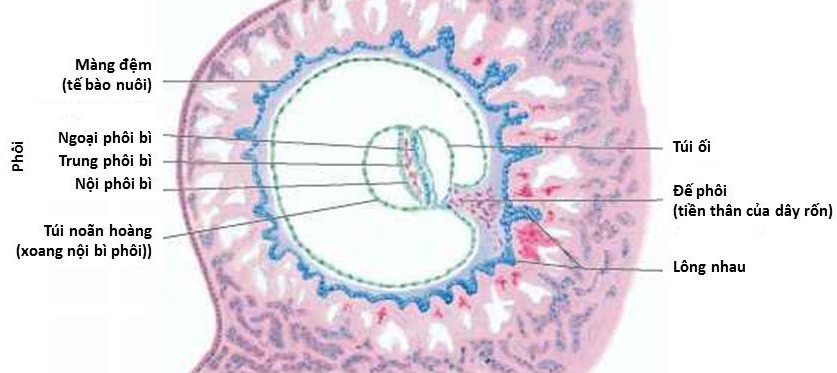
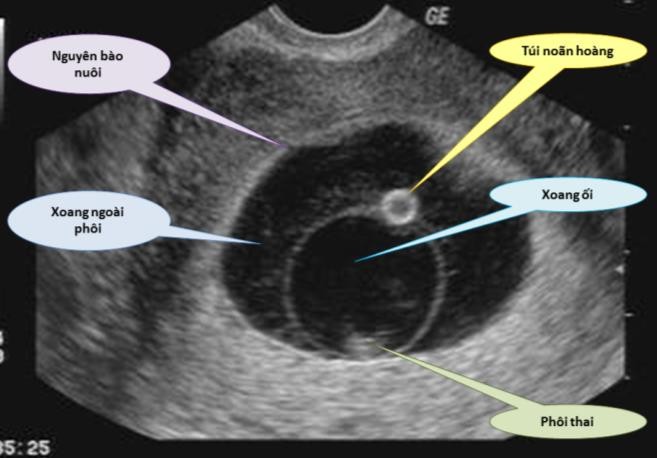
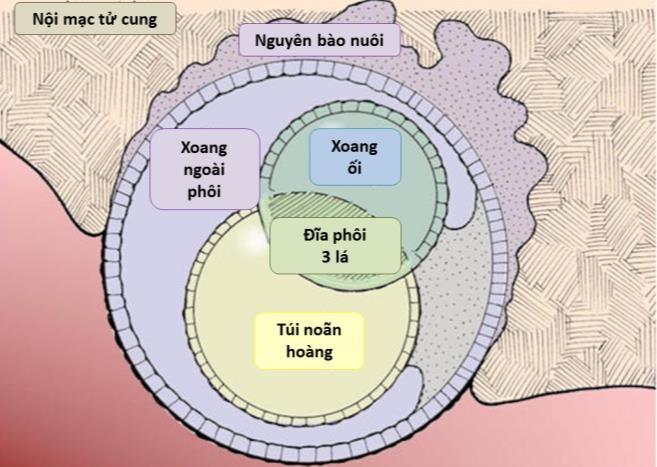
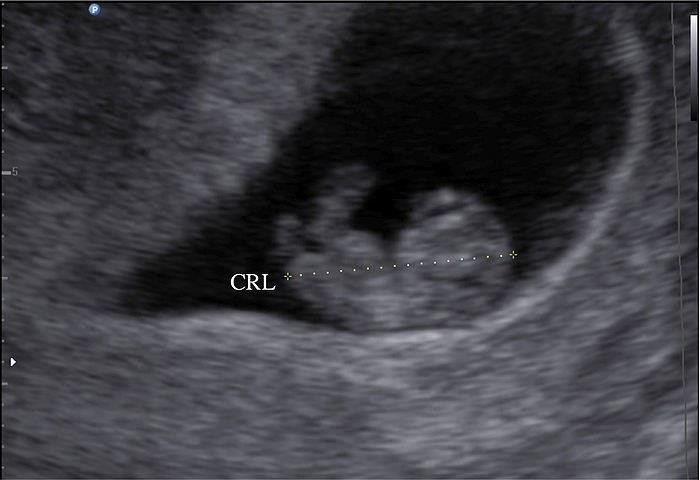
 Cần chẩn đoán phân biệt sẩy thai khó tránh với thai ngoài tử cung ở cổ tử cung. Trong trường hợp này, cần định lượng β-hCG và siêu âm định kỳ để xác định chẩn đoán. Đây là một trong những tình trạng hiếm hoi mà định lượng β-hCG có thể giúp phân định chẩn đoán.
Cần chẩn đoán phân biệt sẩy thai khó tránh với thai ngoài tử cung ở cổ tử cung. Trong trường hợp này, cần định lượng β-hCG và siêu âm định kỳ để xác định chẩn đoán. Đây là một trong những tình trạng hiếm hoi mà định lượng β-hCG có thể giúp phân định chẩn đoán.