Official reprint from UpToDate® www.uptodate.com
Official reprint from UpToDate® www.uptodate.com
©2023 UpToDate®
Vancomycin hypersensitivity
Author: Peter F Weller, MD, MACP
Section Editor: N Franklin Adkinson, Jr, MD
Deputy Editor: Anna M Feldweg, MD Contributor Disclosures
All topics are updated as new evidence becomes available and our peer review process is complete.
Literature review current through: Jul 2023. | This topic last updated: Apr 28, 2023.
INTRODUCTION
Vancomycin causes several different types of hypersensitivity reactions, ranging from localized skin reactions to generalized cardiovascular collapse. The most common adverse reaction is vancomycin infusion reaction (VIR). VIR is a rate-dependent infusion reaction, not a true allergic reaction.
Vancomycin hypersensitivity will be reviewed here. Other antibiotics that commonly cause hypersensitivity reactions include the beta-lactam antibiotics and sulfonamides, and hypersensitivity reaction to these drugs are discussed separately. (See “Penicillin allergy: Immediate reactions” and “Sulfonamide allergy in HIV-uninfected patients”.)
TERMINOLOGY
The terms “red man syndrome” or “red neck syndrome” have commonly been used to describe vancomycin infusion reaction (VIR). Another term that is variably used is vancomycin flushing syndrome or reactions. This terminology originated from the dramatic erythema that develops in some patients in response to infusion of vancomycin, but the terms could be misconstrued as insulting to specific groups of people in the United States, and the emphasis on flushing, which is a prominent feature but not the only one, may lead to the reaction being missed in patients with darker skin [1,2]. Thus, the term “vancomycin infusion reaction” is preferred.
VANCOMYCIN INFUSION REACTION
The most common adverse reaction to vancomycin is “vancomycin infusion reaction (VIR),” previously known as “red man syndrome,” although we will avoid further use of this term for the reasons outlined previously. (See ‘Terminology’ above.)
Route of administration — VIR occurs principally with parenteral administration of vancomycin. Rarely, VIR has been caused by topical administration of vancomycin powder [3]. In contrast, oral administration of vancomycin in subjects with Clostridioides difficile infections does not usually result in systemic absorption [4]. However, for some patients, especially those with impaired kidney function or other abnormalities, oral administration can lead to detectable serum levels of the medication, and VIR to oral vancomycin may be possible [5].
Signs and symptoms — VIR may develop with the first administration of vancomycin. It is characterized by flushing, erythema, and pruritus, usually affecting the upper body, neck, and face more than the lower body. Pains and muscle spasms in the back and chest, dyspnea, and hypotension may also occur [6,7]. Otherwise unexplained hypotension has been reported [8,9]. In a retrospective review of multiinstitutional electronic medical records, amongst 3165 recipients of vancomycin, 491 experienced adverse drug reactions, of which 134 were immediate hypersensitivity reactions [10].
VIR is rarely life threatening, although severe cardiovascular toxicity and even cardiac arrest can occur [8,11]. Immunoglobulin E (IgE) mediated anaphylaxis can present with symptoms similar or identical to those of severe VIR, and clinicians should be mindful of this alternative diagnosis. Unlike VIR, an IgE-mediated reaction to vancomycin does not occur with initial administration but instead requires sensitization to develop from a previous course of vancomycin. (See ‘IgE-mediated anaphylaxis’ below.)
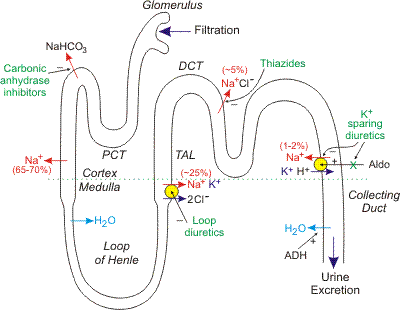
Mechanism — VIR is an idiopathic reaction, which is not thought to involve drug-specific antibodies. VIR is a form of pseudoallergic drug reaction, which is an adverse drug reaction with signs and symptoms that mimic immunologic drug allergies but in which IgE- mediated immunologic mechanisms have not been demonstrated.
Studies in animals indicate that vancomycin directly activates mast cells, resulting in release of vasoactive mediators, such as histamine [12,13]. A mast cell specific G-protein
coupled receptor in mice and its human orthologue, MRGPRX2, have been identified as mediating pseudoallergic mast cell activation, as elicited by candidate agents, including ciprofloxacin [14]. In this study, vancomycin was not evaluated, although vancomycin was shown to activate human mast cells through MRGPRX2 in an in vitro study [15]. (See “Mast cells: Surface receptors and signal transduction”, section on ‘MRGPRX2’.)
In several human studies, the degree of elevation in serum histamine was related to the clinical severity of VIR [16-18]. However, in other studies, increased serum histamine concentrations did not predict VIR, and VIR occurred without detectable elevations in plasma histamine [19], suggesting either that other mediators may be involved or that plasma histamine is not a sufficiently sensitive marker for mast cell activation localized to the skin.
Relationship to infusion rate — VIR is usually a rate-related infusion reaction, as illustrated by the following observations [16,20-22]:
- In one study, 10 healthy presurgical patients received rapid infusions of 1 gram of vancomycin over 10 minutes [20]. All developed VIR, seven had severe cutaneous reactions, and five had a reduction in blood pressure of 20 percent or more, necessitating discontinuation of the infusion.
- In a report of 10 adult male volunteers, the incidence and severity of VIR following the infusion of 1 gram of vancomycin over either one or two hours was compared [16]. Eight subjects developed VIR (two severe, three moderate, and three mild) with the one-hour infusion compared with three (all mild) with the two-hour infusion. However, two studies with a total of 62 hospitalized patients with serious infections found a much lower risk of VIR (less than 10 percent) following 1 gram infused over one hour [17,19].
Predisposing medications — Mast cells are more easily activated when vancomycin is given in combination with certain other medications. The combination of vancomycin and opioids (eg, morphine, meperidine, codeine) enhances dose- or rate-related mast cell degranulation [23]. Adverse reactions can occur following administration of vancomycin in patients being treated with an opioid or following the administration of opioids in patients being treated with vancomycin [24].
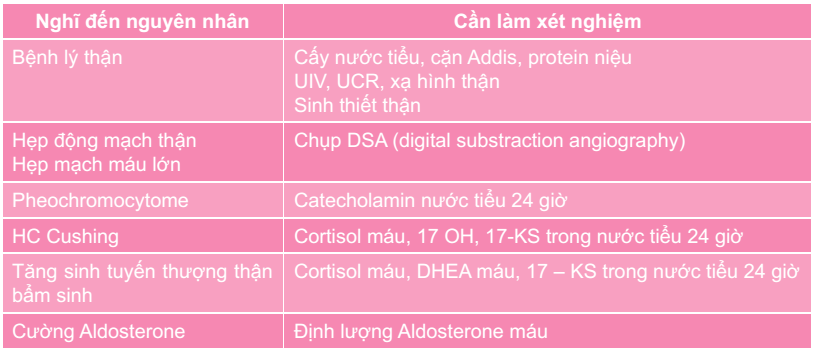
Similar interactions can occur between vancomycin and radiocontrast dye, some muscle
relaxants used in general anesthesia, and any other agents that potentiate mast cell degranulation ( table 1). Thus, when possible, these agents should not be administered simultaneously or in close approximation with vancomycin.
Prevention of initial reactions — Prevention of VIR involves the use of slower infusion rates and, in some situations, premedication.
Slower infusion rates — To avoid VIR, vancomycin should be infused at a rate no higher than 10 mg/minute or, for a 1 gram dose, over a minimum of 100 minutes (whichever results in a slower infusion) [22]. We advise even slower rates of infusion for patients who are also receiving opioids or other medications that predispose to mast cell activation
( table 1). (See ‘Predisposing medications’ above.)
Premedication — Empiric premedication to prevent VIR is not usually necessary for patients who are receiving vancomycin for the first time at rates of infusion ≤10 mg/min. We generally do not administer premedication for doses ≤500 mg given over one hour or doses of 500 mg to 1 gram given over two hours.
In contrast, empiric premedication with antihistamines is commonly employed if more rapid infusions of vancomycin are required in emergency or presurgical settings. We administer premedication for patients receiving vancomycin at high rates of infusion (more than 10 mg/minute or 1 gram over one hour). Oral antihistamines are preferred when possible. Although H1 antihistamines may be sufficient for mildly increased infusion rates, we suggest administration of both an H1 and H2 antihistamine to minimize the likelihood of a reaction if significantly faster rates are used (eg, 1 gram over 10 minutes).
The efficacy of pretreatment with antihistamines in reducing the incidence and severity of VIR was evaluated in the following studies:
- A randomized trial of 33 patients found that pretreatment with diphenhydramine (50 mg orally) completely prevented VIR in a group of patients receiving 1 gram of vancomycin over 60 minutes [17]. Reactions occurred in 47 percent of the placebo group compared with none in the diphenhydramine group.
- In a randomized trial of very rapid infusions (1 gram over 10 minutes) in 30 presurgical patients, oral premedication with both H1 and H2 antihistamines was given [20]. Subjects received oral diphenhydramine (≤1 mg per kg) plus oral
cimetidine (≤4 mg per kg) one hour before infusion. The incidence and severity of VIR were significantly lower in the antihistamine-treated group, although one antihistamine-treated patient had intolerable itching and could not complete the infusion. Hypotension did not occur in the antihistamine group but developed in 50 percent of patients in the placebo group.
- The same investigators performed another randomized trial in 40 patients using the same medications, doses, and setting as in the previous trial (ie, 1 gram over 10 minutes), although the antihistamine premedications (diphenhydramine and cimetidine) were administered intravenously [25]. Patients treated with an antihistamine had significantly lower rates of hypotension (11 versus 63 percent) and cutaneous findings (63 versus 100 percent). Itching was severe enough in two antihistamine-treated patients to necessitate discontinuation of the infusion.
Based upon these limited data, premedication with H1 alone may be sufficient to prevent VIR following mildly increased rates of infusion, although even the combination of H1 and H2 antihistamines did not completely prevent VIR following very rapid infusions (1 gram over 10 minutes) of vancomycin. Oral and intravenous antihistamine premedications appear to be similarly efficacious.
Management — The optimal management of VIR has not been evaluated in randomized trials. The approach outlined herein is based upon the author’s clinical experience.
- For mild reactions (eg, flushing that is not bothersome to the patient), symptoms typically resolve in minutes, and antihistamines are usually not necessary. We usually restart the infusion at one-half of the previous rate.
- For moderate reactions (eg, the patient is uncomfortable due to flushing or pruritus but hemodynamically stable and not experiencing chest pain or muscle spasm), we typically interrupt the infusion and treat with diphenhydramine (50 mg orally or intravenously) and famotidine (20 mg intravenously). Symptoms usually subside promptly. The infusion can then be restarted at one-half the original rate or 10 mg/minute, whichever is slower.
- For severe reactions (eg, involving muscle spasm, chest pain, or hypotension), we stop the infusion and treat with diphenhydramine (50 mg intravenously) as well as famotidine (20 mg intravenously) and, if hypotension is present, intravenous fluids.
Once symptoms have resolved, the infusion can be restarted and given over four or more hours. For administration of future doses, we suggest repeat premedication with antihistamines before each dose and infusion over four hours, as well as continuous hemodynamic monitoring during infusions.
- It may be difficult or impossible to distinguish severe VIR from anaphylaxis. Flushing and hypotension are features of both reactions. Hives, laryngeal edema, and wheezing are suggestive of anaphylaxis, and patients with these signs and symptoms should be treated with intramuscular epinephrine, in addition to the measures above. Overviews of the treatment of anaphylaxis in adults and in children (with specific medication doses) are provided in the tables ( table 2 and table 3). Infusions must not be restarted if anaphylaxis is suspected, because slowing the rate and administering premedications will not prevent IgE-mediated anaphylaxis. (See ‘IgE- mediated anaphylaxis’ below.)
Following VIR of any severity, the patient’s medication list should be reviewed to determine if other predisposing medications (eg, opioids) ( table 1) can be identified and discontinued before restarting the infusion.
Recurrent reactions — Some individuals experience recurrent and persistent symptoms despite premedication and slower infusion rates [17,24,26]. These individuals may have mast cells and/or basophils that are easily activated. Patients with mast cell disorders are particularly prone to VIR with vancomycin. (See “Mastocytosis (cutaneous and systemic) in children: Epidemiology, clinical manifestations, evaluation, and diagnosis”, section on ‘Triggers for mediator release’ and “Mastocytosis (cutaneous and systemic) in adults: Epidemiology, pathogenesis, clinical manifestations, and diagnosis”.)
Desensitization can be attempted if there is no equally effective alternative antibiotic and vancomycin is absolutely required. (See ‘Desensitization’ below.)
IgE-MEDIATED ANAPHYLAXIS
Anaphylaxis is an immunologically mediated reaction involving drug-specific IgE antibodies. Anaphylaxis in response to vancomycin administration is believed to be rare, although reactions involving angioedema, respiratory distress, and bronchospasm with demonstrable drug-specific IgE have been described [26-28]. (See “Anaphylaxis: Emergency
treatment”.)
Patients with anaphylactic reactions to vancomycin often have a history of multiple prior exposures. Anaphylaxis does not occur on the first administration of the medication, because prior exposure to the drug is necessary to form drug-specific IgE antibodies.
Clinical manifestations — The symptoms of anaphylaxis include (but are not limited to) urticaria, angioedema, generalized pruritus, tachycardia, hypotension, nausea and vomiting, lightheadedness, and hypotension ( table 4).
Although severe vancomycin infusion reactions (VIR) and anaphylaxis can present with similar signs and symptoms, wheezing and respiratory distress are more common in anaphylaxis, whereas VIR more often involves chest pains causing a sensation of chest tightness. Angioedema is usually seen in anaphylaxis only. However, it may not be possible to distinguish anaphylaxis from severe VIR based upon clinical presentation. The patient should be assumed to have anaphylaxis in such cases and managed accordingly.
Acute management — If anaphylaxis is suspected, the vancomycin infusion should be stopped immediately, and the patient should be treated with intramuscular epinephrine. Overviews of the treatment of anaphylaxis in adults and in children (with specific medication doses) are provided in the tables ( table 2 and table 3). A more detailed discussion of the treatment of anaphylaxis is presented separately. (See “Anaphylaxis: Emergency treatment”.)
Diagnosis — Differentiating between anaphylaxis and severe VIR is usually based upon clinical signs and symptoms. Unfortunately, serum and skin tests cannot reliably discriminate between these two reactions. In addition, vancomycin skin testing has not been validated, and the positive and negative predictive values are unknown.
Serum tests — Serum tryptase levels have been studied in severe reactions to vancomycin [29-35]. Tryptase is stored preformed within mast cell granules and released during mast cell degranulation. Elevations in these mast cell-derived mediators are variably found in IgE-mediated anaphylaxis, although normal levels do not exclude anaphylaxis. (See “Laboratory tests to support the clinical diagnosis of anaphylaxis”, section on ‘Tryptase’.)
Skin testing — Skin testing with vancomycin has not been validated, and the positive and
negative predictive value of the results are not known. However, isolated case reports described reactions that were highly suggestive of IgE-mediated drug allergy in which skin test results were positive [36]. As an example, one patient developed generalized urticaria and respiratory distress after several doses of vancomycin [27]. Intradermal skin tests were positive at 0.1 mcg/mL, whereas control subjects had positive results only at much higher concentrations (>10 mcg/mL). The patient was desensitized over 13 days, after which repeat skin testing was negative, which is a clinical marker of successful desensitization in IgE-mediated reactions. Another case report also documented positive skin tests results that converted to negative following desensitization [37]. (See ‘Desensitization’ below.)
These reports suggest that skin testing with appropriate vancomycin concentrations may reflect clinical reactivity and provide supportive evidence for the clinical diagnosis of anaphylaxis. A positive skin test at concentrations of 1 mcg/mL or lower is strongly suggestive of drug allergy in a patient with a reaction that had features of allergy.
Use of alternate medications — Other antimicrobial agents should be considered for patients who have experienced very severe symptoms in response to vancomycin. Some patients receive vancomycin because of a reported history of allergy to penicillins, yet penicillin may be a superior antibiotic for certain infections, such as native valve endocarditis due to methicillin-sensitive Staphylococcus aureus. (See “Antimicrobial therapy of left-sided native valve endocarditis”.)
Patients are sometimes labeled as penicillin allergic based on a vague past history or may have lost the allergy over time. Presurgical evaluation by an allergy specialist to confirm or exclude penicillin allergy should be arranged whenever possible. Several studies have demonstrated the value of avoiding vancomycin for surgical prophylaxis in patients with a self-reported history of penicillin allergy [38-40]. (See “Penicillin allergy: Immediate reactions”, section on ‘Impact of penicillin allergy on care’.)
There are limited antibiotic options for certain infections, however, such as methicillin- resistant S. aureus, coagulase-negative staphylococci, and ampicillin-resistant enterococci. Daptomycin has been used successfully in a patient intolerant to vancomycin [41].
Alternative agents are discussed in detail in specific topic reviews. (See “Methicillin- resistant Staphylococcus aureus (MRSA) in adults: Treatment of bacteremia” and “Infection due to coagulase-negative staphylococci: Treatment” and “Treatment of enterococcal infections”.)
Glycopeptide antibiotics structurally similar to vancomycin include telavancin, dalbavancin, and oritavancin [42]. (See ‘Use of related drugs’ below.)
Desensitization — Desensitization is a procedure that alters the immune activation by the drug and results in temporary tolerance, allowing the patient with a drug hypersensitivity reaction to receive an uninterrupted course of the medication safely. (See “Rapid drug desensitization for immediate hypersensitivity reactions”.)
Indications — Readministration of vancomycin to a patient with a past severe VIR or possible anaphylaxis may need to be considered when no other antimicrobial of equivalent efficacy is available. Vancomycin desensitization is appropriate for both suspected IgE-mediated reactions (preferably confirmed by skin testing) and may be clinically useful for severe VIR that was refractory to the measures outlined above [24,27,37,43,44]. (See ‘Management’ above.)
Precautions — Desensitization, or any form of reexposure, is contraindicated in patients with the following types of past reactions:
- Exfoliative skin reactions – Reactions involving blistering, peeling, or sloughing of the skin, such as Stevens-Johnson syndrome and toxic epidermal necrolysis (see “Stevens-
Johnson syndrome and toxic epidermal necrolysis: Management, prognosis, and long-term sequelae”)
- Drug reaction with eosinophilia and systemic symptoms (DRESS), also called the drug- induced hypersensitivity syndrome [45,46] (see “Drug hypersensitivity: Classification and clinical features”)
Desensitization is generally not performed in patients with past drug fever, hematologic or renal hypersensitivity reactions, phlebitis, or linear immunoglobulin A (IgA) bullous dermatosis. (See ‘Other forms of hypersensitivity’ below.)
Referral — Consultation with an allergy specialist experienced in adverse drug reactions is recommended if desensitization is under consideration. Precautions regarding desensitization include the following:
- Desensitization is performed immediately before required treatment because maintaining tolerance requires continual exposure to the drug.
- Other concurrent health issues should be as well controlled as possible, particularly cardiopulmonary conditions (eg, heart failure, asthma).
- Patients should optimally not be taking medications that may increase the likelihood of anaphylaxis or interfere with treatment of anaphylaxis, such as angiotensin- converting enzyme inhibitors or beta blockers.
- Desensitizations should be performed in an appropriate medical setting, with proper monitoring and immediate availability of rescue medications and equipment. Desensitizations for IgE-mediated sensitivities to intravenous medications are usually performed in an intensive care unit.
- Documentation of informed consent, including a thorough discussion of risks and benefits of the procedure, is essential.
The safety of desensitization as a general technique is reviewed separately. (See “Rapid drug desensitization for immediate hypersensitivity reactions”, section on ‘Safety’.)
Protocols — A variety of intravenous protocols have been published. Most can be completed over several hours, which is important for patients who are infected and acutely in need of treatment [24,43,47-49]. Other protocols involve intermittent doses that increase incrementally over periods ranging from 2 to 13 days [27,37]. Studies comparing the success rates of different protocols have not been performed.
A protocol that can be completed in several hours is provided ( table 5) [47].
Symptoms during desensitization — Symptoms during desensitization have been noted in as many as 30 percent of cases and are usually mild (eg, flushing, pruritus, limited urticaria). Most symptoms can be managed without discontinuation of the desensitization protocol. Mild symptoms are managed by halting the infusion and treating the symptoms that do not subside spontaneously. Once symptoms have subsided, the last tolerated step is repeated. This “stepping back” may be performed again if needed, or an intermediate step can be inserted after the last tolerated step and before the problematic step by reducing the infusion rate of the problematic step.
If moderate or severe symptoms develop, the infusion should be halted and the symptoms treated. The decision to proceed with desensitization depends upon the patient’s status and need for vancomycin.
There is one report of a patient who failed a rapid protocol and was subsequently successfully desensitized using a 13-day procedure [37].
Duration of effect — Desensitization induces a temporary state of tolerance, allowing the drug to be administered safely as long as the patient remains continually exposed to it.
Once the initial desensitization is complete, the patient can receive subsequent doses normally, and no symptoms are anticipated. However, serum levels of vancomycin must be monitored carefully to ensure that the concentration in the blood does not drop below detectable levels [28,50]. It is not known what threshold level of drug is required to maintain the tolerized state. However, the drug levels should be kept within the therapeutic range if possible, both to maintain tolerance and treat the infection. This may require continuous, rather than intermittent, dose infusions.
If the drug level becomes undetectable, then desensitization should be repeated in order to reintroduce the medication safely. Once the course of treatment is completed, it must be clearly explained to patients that they still have an allergy to vancomycin and would have to be desensitized again if it were required in the future.
OTHER FORMS OF HYPERSENSITIVITY
The most common hypersensitivity reaction to vancomycin is skin rash. Other reactions, not all of which are immune mediated, include hematologic and kidney disorders, drug fever, and phlebitis [51,52].
DRESS — Vancomycin has elicited drug reaction with eosinophilia and systemic symptoms (DRESS), which is also called drug-induced hypersensitivity syndrome [45,53-55]. This drug reaction involves rash, atypical lymphocytosis, frequent but not uniform eosinophilia, and, often, lymphadenopathy. There may be hepatic, kidney, and/or pulmonary involvement.
Treatment involves discontinuing the causative drug and, conventionally, administration of glucocorticoids [46,54]. Amongst an extensive review of electronic medical records of patients developing DRESS, antibiotics accounted for 74 percent, with vancomycin the most common antibiotic (39 percent) overall [56]. (See “Drug reaction with eosinophilia and systemic symptoms (DRESS)”.)
Expression of the HLA-A*32:01 allele was found in 83 percent of 23 cases of vancomycin- elicited DRESS versus 0 percent in vancomycin-tolerant control subjects [57]. The authors
suggest that, while administration of vancomycin often needs to be initiated rapidly, since DRESS will not develop usually until after two weeks of drug administration, testing for the HLA-A*32:01 allele be performed soon after initiation of the drug to assess genetic risks for DRESS development. Any drug culprit in DRESS should be avoided in the future as rechallenge can precipitate severe and fatal reactions.
Dermatologic — The most common form of vancomycin hypersensitivity reaction is skin rash. Other dermatologic reactions include linear IgA bullous dermatosis (LABD) and various other rare disorders.
Maculopapular and urticarial eruptions — Maculopapular skin eruptions are the most frequent dermatologic manifestations of vancomycin hypersensitivity [58-62]. In a systematic review of patients receiving teicoplanin or vancomycin, skin rashes occurred in 57 of 889 (6 percent), while vancomycin infusion reaction (VIR) occurred in 18 of 414 (4 percent) [62]. Urticarial eruptions are also reported [60].
Vancomycin-related linear IgA bullous dermatosis — LABD is an autoantibody- mediated skin reaction to vancomycin ( ![]() picture 1) [63-69]. In a review of immune- mediated reactions to vancomycin, LABD was the most commonly identified immune- mediated adverse reaction [36]. This entity may be confused with toxic epidermal necrolysis, although LABD does not usually involve mucosal membranes [70-72]. In addition, a nonbullous, morbilliform variant of vancomycin-induced LABD has been reported [73]. LABD can appear from one day to one month from the time of initial vancomycin administration. The reaction appears to be idiosyncratic and unrelated to peak or trough serum vancomycin levels. LABD is discussed in more detail separately. (See “Linear IgA bullous dermatosis”.)
picture 1) [63-69]. In a review of immune- mediated reactions to vancomycin, LABD was the most commonly identified immune- mediated adverse reaction [36]. This entity may be confused with toxic epidermal necrolysis, although LABD does not usually involve mucosal membranes [70-72]. In addition, a nonbullous, morbilliform variant of vancomycin-induced LABD has been reported [73]. LABD can appear from one day to one month from the time of initial vancomycin administration. The reaction appears to be idiosyncratic and unrelated to peak or trough serum vancomycin levels. LABD is discussed in more detail separately. (See “Linear IgA bullous dermatosis”.)
Rare severe cutaneous reactions — Stevens-Johnson syndrome [74,75], exfoliative dermatitis [76], toxic epidermal necrolysis [77], extensive fixed drug eruption [78], and leukocytoclastic vasculitis [79] have all been described in association with vancomycin use in case reports. Early recognition and discontinuation of the drug are critical.
Desensitization has no efficacy in these reactions and should not be performed for the purposes of circumventing recurrence, as reexposure to the drug could result in a more severe or fatal recurrence of the reaction. (See “Stevens-Johnson syndrome and toxic epidermal necrolysis: Pathogenesis, clinical manifestations, and diagnosis”.)
Hematologic — Hematologic manifestations of vancomycin-related reactions include
leukocytosis, eosinophilia, neutropenia, and immune thrombocytopenia [59,80-85]. Neutropenia tends to occur with longer courses of therapy, and weekly monitoring of the white blood cell count and differential leukocyte counts during prolonged administration is indicated [86]. A case of agranulocytosis in a patient with kidney insufficiency was also reported [18]. Vancomycin should be discontinued if these conditions develop.
Drug-induced fever — Uncommonly, vancomycin has been implicated as a cause of drug- induced fever [51,52,87]. In some instances, fever has occurred concomitant with vancomycin-elicited neutropenia [58,81].
Kidney — Vancomycin may cause nephrotoxicity, especially in patients receiving confounding nephrotoxins or who have kidney insufficiency or altered hemodynamics [88- 90]. (See “Vancomycin: Parenteral dosing, monitoring, and adverse effects in adults”.)
On occasion, vancomycin can also elicit immunologically mediated kidney damage due to acute interstitial nephritis [91-93]. Vancomycin should be discontinued if it is a likely cause of acute interstitial nephritis. (See “Clinical manifestations and diagnosis of acute interstitial nephritis”.)
USE OF RELATED DRUGS
Glycopeptide antibiotic analogs — The agents that share structural similarities with vancomycin include teicoplanin, dalbavancin, oritavancin, and telavancin [42]. Teicoplanin has been in use longer than the other agents, so there is more experience with the adverse reactions it can cause.
Teicoplanin — Teicoplanin, which is not available in the United States, is a glycopeptide antimicrobial with structural similarity to vancomycin, equivalent efficacy in treating invasive beta-lactam-resistant, gram-positive infections, but with apparently lower rates of adverse events, particularly nephrotoxicity and vancomycin infusion reaction (VIR) [62,94- 96].
- Teicoplanin can cause flushing and pruritus, but clinically significant infusion reactions are rare with teicoplanin [94,97,98].
- Teicoplanin has been implicated in perioperative anaphylaxis [99-101].
There is only limited information about the safety of teicoplanin in patients with a previous hypersensitivity reaction to vancomycin:
- Recurrence of vasculitic rash was described in two patients treated with teicoplanin who had previously reacted to vancomycin [102].
- A retrospective series evaluated 117 patients who had drug-induced fever (24 patients), rash (77 patients), both (8 patients), or neutropenia (8 patients) while receiving vancomycin and were switched to teicoplanin [58]. Clinical information and the development of drug-induced fever, rash, or neutropenia with teicoplanin were determined by medical record review. Ten percent of patients developed fever, rash, or neutropenia in response to teicoplanin; there were no fatalities due to drug adverse reactions to teicoplanin. Of note, 50 percent of patients with neutropenia in response to vancomycin also developed neutropenia in response to teicoplanin. Thus, the majority of patients in the series tolerated teicoplanin, with the exception of those with neutropenia, in whom one-half had recurrence.
- Teicoplanin can induce drug reaction with eosinophilia and systemic symptoms (DRESS)/drug-induced hypersensitivity syndrome, like vancomycin [45,53]. Cross- sensitivity to both drugs is possible, as described in at least one case report [45].
Dalbavancin, oritavancin, and telavancin — These analogs of vancomycin are approved for use in the United States, including for skin and skin structure infections [42]. Telavancin is administered daily, while oritavancin and dalbavancin are long lived and are usually given as a single dose. While the long-lasting antimicrobial effects of these agents are beneficial, adverse reactions to these agents may produce persistent symptoms that extend well beyond discontinuation of the drug.
Reports of adverse effects from these agents are limited but appear to be less common than with vancomycin [103].
- VIR-like reactions have been reported with both dalbavancin and oritavancin and can be managed with slower infusion rates [104].
- Anaphylaxis has also been reported with both agents, but details that might distinguish IgE-mediated anaphylaxis from nonimmune-mediated pseudoallergic reactions are not available [104].
Reports of adverse reactions to dalbavancin and oritavancin in patients with previous serious adverse reactions to vancomycin are also limited, and we would advise exploring other options before using related glycopeptide agents. Specifically, alternative antibiotics should be utilized when possible. If the concern is about a VIR-like infusion-related event, appropriate precautions should be taken (slower infusion rate, consideration of relevant coadministered medications) ( table 1).
Graded challenge has be performed in a controlled setting to ascertain if a patient with a previous immediate hypersensitivity reaction to vancomycin could tolerate one of the newer glycopeptide agents. One case report described a graded challenge of dalbavancin in a patient with a past severe hypersensitivity reaction to vancomycin [105]. However, the patient was also receiving opioids and had other conditions that could have potentiated the reaction to vancomycin, so the safety of this approach in other patients with severe hypersensitivity is unclear.
SOCIETY GUIDELINE LINKS
Links to society and government-sponsored guidelines from selected countries and regions around the world are provided separately. (See “Society guideline links: Drug allergy and hypersensitivity”.)
SUMMARY AND RECOMMENDATIONS
- Terminology and clinical manifestations – Vancomycin infusion reaction (VIR; also known as “red man syndrome,” though we avoid the use of this term going forward) is a common adverse reaction to vancomycin. VIR is characterized by flushing, erythema, and pruritus, usually of the upper body. Chest or back pains and hypotension may also occur. It is a rate-related infusion reaction caused by direct activation of mast cells by the drug. Other agents that activate mast cells, such as opioids, muscle relaxants, and radiocontrast media, can predispose patients to developing VIR with vancomycin infusion. (See ‘Vancomycin infusion reaction’ above.)
- Slower infusion rates can prevent VIR – VIR can usually be prevented by administering the drug at rates ≤10 mg/minute (or 1 gram over more than 100 minutes). We do not empirically premedicate patients who have no history of
previous VIR or have never received vancomycin before if the drug is to be administered at these rates. (See ‘Prevention of initial reactions’ above.)
- Premedication for patients who require faster infusions – In patients who require more rapid infusions of vancomycin (ie, at rates exceeding 10 mg/minute or 1 gram over one hour), we recommend antihistamine premedication with at least an H1 antihistamine (Grade 1B). We suggest a combination of H1 and H2 antihistamines (Grade 2C). We administer the combination of diphenhydramine (50 mg orally) and famotidine (20 mg orally) one hour before infusion, although the optimal regimen has not been determined. (See ‘Prevention of initial reactions’ above.)
- Treatment of VIR – VIR is treated by stopping the infusion. Further treatment depends upon the severity of the reaction. The patient’s medication list should be reviewed carefully to determine if other predisposing medications can be identified and discontinued ( table 1). (See ‘Management’ above.)
- For mild reactions (eg, flushing that is not bothersome to the patient), symptoms typically resolve in minutes, and antihistamines are usually not necessary. We usually restart the infusion at one-half of the previous rate.
- For moderate reactions (eg, the patient is uncomfortable due to flushing or pruritus but is hemodynamically stable and not experiencing chest pain or muscle spasm), we suggest treating with an H1 antihistamine (Grade 2C). We administer diphenhydramine (50 mg orally or intravenously). We usually restart the infusion at one-half of the previous rate.
- For severe reactions (eg, muscle spasms, chest pain, or hypotension), in addition to stopping the infusion, we suggest treatment with both H1 and H2 antihistamines (Grade 2C). We administer diphenhydramine (50 mg intravenously) and famotidine (20 mg intravenously). Intravenous fluids may be needed for hypotension. We suggest infusing any subsequent doses of vancomycin over four hours with continuous hemodynamic monitoring during infusions.
- Prevention of repeat reactions – For patients with a previous history of VIR who require vancomycin again, we recommend antihistamine premedication with at least an H1 antihistamine (Grade 1B). We suggest a combination of H1 and H2 antihistamines (Grade 2C). We administer the combination of diphenhydramine (50
mg orally) and famotidine (20 mg orally) one hour before infusion and infuse each vancomycin dose over four hours.
- Indications for desensitization – For patients with recurrent VIR despite premedication and slow infusion rates who absolutely require vancomycin in the future, we suggest desensitization (Grade 2C). Desensitization involves gradually reintroducing the culprit drug in serially increasing doses to induce a state of temporary clinical tolerance. There are several published protocols. We prefer a rapid protocol that allows the patient to receive a full dose of vancomycin within several hours ( table 5). (See ‘Desensitization’ above.)
- Rare anaphylaxis – Anaphylaxis in response to vancomycin administration is rare. Symptoms of anaphylaxis overlap with those of severe VIR, although wheezing, significant dyspnea, and angioedema are more suggestive of anaphylaxis ( table 4). Multiple prior vancomycin courses should raise concern about the potential for immunoglobulin E (IgE) mediated anaphylaxis. (See ‘Clinical manifestations’ above.)
- Treatment – For patients with anaphylaxis of any severity:
- The infusion should be stopped immediately and not restarted.
- Epinephrine should be administered promptly, at the doses specified for adults ( table 2) or children ( table 3). (See ‘Acute management’ above and “Anaphylaxis: Emergency treatment”, section on ‘Immediate management’.)
- Future management options – For patients with past anaphylaxis to vancomycin, an alternative drug should be used whenever possible. For patients with serious infections that cannot be adequately treated with alternate antibiotics, we suggest vancomycin desensitization (Grade 2C). (See ‘Desensitization’ above.)
- Treatment – For patients with anaphylaxis of any severity:
- Other rare types of reactions – Other rare forms of vancomycin hypersensitivity include drug reaction with eosinophilia and systemic symptoms (DRESS)/drug- induced hypersensitivity syndrome, linear immunoglobulin A (IgA) bullous dermatosis (LABD) (
 picture 1), and immune-mediated hematologic and kidney disorders. The drug must be discontinued if these occur. Desensitization in patients with these reactions is not effective and may be dangerous. (See ‘Other forms of hypersensitivity’ above.)
picture 1), and immune-mediated hematologic and kidney disorders. The drug must be discontinued if these occur. Desensitization in patients with these reactions is not effective and may be dangerous. (See ‘Other forms of hypersensitivity’ above.)
REFERENCES
- Austin JP, Foster BA, Empey A. Replace Red Man Syndrome With Vancomycin Flushing Reaction. Hosp Pediatr 2020; 10:623.
- Alvarez-Arango S, Ogunwole SM, Sequist TD, et al. Vancomycin Infusion Reaction – Moving beyond “Red Man Syndrome”. N Engl J Med 2021; 384:1283.
- Nagahama Y, VanBeek MJ, Greenlee JDW. Red man syndrome caused by vancomycin powder. J Clin Neurosci 2018; 50:149.
- Rao S, Kupfer Y, Pagala M, et al. Systemic absorption of oral vancomycin in patients with Clostridium difficile infection. Scand J Infect Dis 2011; 43:386.
- Bergeron L, Boucher FD. Possible red-man syndrome associated with systemic absorption of oral vancomycin in a child with normal renal function. Ann Pharmacother 1994; 28:581.
- Symons NL, Hobbes AF, Leaver HK. Anaphylactoid reactions to vancomycin during anaesthesia: two clinical reports. Can Anaesth Soc J 1985; 32:178.
- Hepner DL, Castells MC. Anaphylaxis during the perioperative period. Anesth Analg 2003; 97:1381.
- Glicklich D, Figura I. Vancomycin and cardiac arrest. Ann Intern Med 1984; 101:880.
- Hicks RW, Hernandez J. Perioperative pharmacology: a focus on vancomycin. AORN J 2011; 93:593.
- Foer D, Wien M, Karlson EW, et al. Patient Characteristics Associated With Reactions to Mrgprx2-Activating Drugs in an Electronic Health Record-Linked Biobank. J Allergy Clin Immunol Pract 2023; 11:492.
- Mayhew JF, Deutsch S. Cardiac arrest following administration of vancomycin. Can Anaesth Soc J 1985; 32:65.
- Veien M, Szlam F, Holden JT, et al. Mechanisms of nonimmunological histamine and tryptase release from human cutaneous mast cells. Anesthesiology 2000; 92:1074.
- Horinouchi Y, Abe K, Kubo K, Oka M. Mechanisms of vancomycin-induced histamine release from rat peritoneal mast cells. Agents Actions 1993; 40:28.
- McNeil BD, Pundir P, Meeker S, et al. Identification of a mast-cell-specific receptor crucial for pseudo-allergic drug reactions. Nature 2015; 519:237.
- Navinés-Ferrer A, Serrano-Candelas E, Lafuente A, et al. MRGPRX2-mediated mast cell
response to drugs used in perioperative procedures and anaesthesia. Sci Rep 2018; 8:11628.
- Healy DP, Sahai JV, Fuller SH, Polk RE. Vancomycin-induced histamine release and “red man syndrome”: comparison of 1- and 2-hour infusions. Antimicrob Agents Chemother 1990; 34:550.
- Wallace MR, Mascola JR, Oldfield EC 3rd. Red man syndrome: incidence, etiology, and prophylaxis. J Infect Dis 1991; 164:1180.
- Adrouny A, Meguerditchian S, Koo CH, et al. Agranulocytosis related to vancomycin therapy. Am J Med 1986; 81:1059.
- O’Sullivan TL, Ruffing MJ, Lamp KC, et al. Prospective evaluation of red man syndrome in patients receiving vancomycin. J Infect Dis 1993; 168:773.
- Renz CL, Thurn JD, Finn HA, et al. Oral antihistamines reduce the side effects from rapid vancomycin infusion. Anesth Analg 1998; 87:681.
- Newfield P, Roizen MF. Hazards of rapid administration of vancomycin. Ann Intern Med 1979; 91:581.
- Polk RE, Healy DP, Schwartz LB, et al. Vancomycin and the red-man syndrome: pharmacodynamics of histamine release. J Infect Dis 1988; 157:502.
- Levy JH, Marty AT. Vancomycin and adverse drug reactions. Crit Care Med 1993; 21:1107.
- Wong JT, Ripple RE, MacLean JA, et al. Vancomycin hypersensitivity: synergism with narcotics and “desensitization” by a rapid continuous intravenous protocol. J Allergy Clin Immunol 1994; 94:189.
- Renz CL, Thurn JD, Finn HA, et al. Antihistamine prophylaxis permits rapid vancomycin infusion. Crit Care Med 1999; 27:1732.
- Hassaballa H, Mallick N, Orlowski J. Vancomycin anaphylaxis in a patient with vancomycin-induced red man syndrome. Am J Ther 2000; 7:319.
- Anne’ S, Middleton E Jr, Reisman RE. Vancomycin anaphylaxis and successful desensitization. Ann Allergy 1994; 73:402.
- Chopra N, Oppenheimer J, Derimanov GS, Fine PL. Vancomycin anaphylaxis and successful desensitization in a patient with end stage renal disease on hemodialysis by maintaining steady antibiotic levels. Ann Allergy Asthma Immunol 2000; 84:633.
- Fisher MM, Baldo BA. Mast cell tryptase in anaesthetic anaphylactoid reactions. Br J Anaesth 1998; 80:26.
- Renz CL, Laroche D, Thurn JD, et al. Tryptase levels are not increased during vancomycin-induced anaphylactoid reactions. Anesthesiology 1998; 89:620.
- Laroche D, Vergnaud MC, Sillard B, et al. Biochemical markers of anaphylactoid reactions to drugs. Comparison of plasma histamine and tryptase. Anesthesiology 1991; 75:945.
- Schwartz LB, Yunginger JW, Miller J, et al. Time course of appearance and disappearance of human mast cell tryptase in the circulation after anaphylaxis. J Clin Invest 1989; 83:1551.
- Matsson P, Enander I, Andersson AS, et al. Evaluation of mast cell activation (tryptase) in two patients suffering from drug-induced hypotensoid reactions. Agents Actions 1991; 33:218.
- Ordoqui E, Zubeldia JM, Aranzábal A, et al. Serum tryptase levels in adverse drug reactions. Allergy 1997; 52:1102.
- Schwartz LB, Bradford TR, Rouse C, et al. Development of a new, more sensitive immunoassay for human tryptase: use in systemic anaphylaxis. J Clin Immunol 1994; 14:190.
- Minhas JS, Wickner PG, Long AA, et al. Immune-mediated reactions to vancomycin: A systematic case review and analysis. Ann Allergy Asthma Immunol 2016; 116:544.
- Lin RY. Desensitization in the management of vancomycin hypersensitivity. Arch Intern Med 1990; 150:2197.
- Perencevich EN, Weller PF, Samore MH, Harris AD. Benefits of negative penicillin skin test results persist during subsequent hospital admissions. Clin Infect Dis 2001; 32:317.
- Frigas E, Park MA, Narr BJ, et al. Preoperative evaluation of patients with history of allergy to penicillin: comparison of 2 models of practice. Mayo Clin Proc 2008; 83:651.
- Park M, Markus P, Matesic D, Li JT. Safety and effectiveness of a preoperative allergy clinic in decreasing vancomycin use in patients with a history of penicillin allergy. Ann Allergy Asthma Immunol 2006; 97:681.
- Gilmore JF, Kim M, LaSalvia MT, Mahoney MV. Treatment of enterococcal peritonitis with intraperitoneal daptomycin in a vancomycin-allergic patient and a review of the
literature. Perit Dial Int 2013; 33:353.
- Blaskovich MAT, Hansford KA, Butler MS, et al. Developments in Glycopeptide Antibiotics. ACS Infect Dis 2018; 4:715.
- Villavicencio AT, Hey LA, Patel D, Bressler P. Acute cardiac and pulmonary arrest after infusion of vancomycin with subsequent desensitization. J Allergy Clin Immunol 1997; 100:853.
- Kitazawa T, Ota Y, Kada N, et al. Successful vancomycin desensitization with a combination of rapid and slow infusion methods. Intern Med 2006; 45:317.
- Kwon HS, Chang YS, Jeong YY, et al. A case of hypersensitivity syndrome to both vancomycin and teicoplanin. J Korean Med Sci 2006; 21:1108.
- Ben m’rad M, Leclerc-Mercier S, Blanche P, et al. Drug-induced hypersensitivity syndrome: clinical and biologic disease patterns in 24 patients. Medicine (Baltimore) 2009; 88:131.
- Wazny LD, Daghigh B. Desensitization protocols for vancomycin hypersensitivity. Ann Pharmacother 2001; 35:1458.
- Lerner A, Dwyer JM. Desensitization to vancomycin. Ann Intern Med 1984; 100:157.
- Castells M. Desensitization for drug allergy. Curr Opin Allergy Clin Immunol 2006; 6:476.
- Sorensen SJ, Wise SL, al-Tawfiq JA, et al. Successful vancomycin desensitization in a patient with end-stage renal disease and anaphylactic shock to vancomycin. Ann Pharmacother 1998; 32:1020.
- Clayman MD, Capaldo RA. Vancomycin allergy presenting as fever of unknown origin. Arch Intern Med 1989; 149:1425.
- Rocha JL, Kondo W, Baptista MI, et al. Uncommon vancomycin-induced side effects. Braz J Infect Dis 2002; 6:196.
- Tamagawa-Mineoka R, Katoh N, Nara T, et al. DRESS syndrome caused by teicoplanin and vancomycin, associated with reactivation of human herpesvirus-6. Int J Dermatol 2007; 46:654.
- Vauthey L, Uçkay I, Abrassart S, et al. Vancomycin-induced DRESS syndrome in a female patient. Pharmacology 2008; 82:138.
- Boet S, Noblet C, Haas-Hubscher C, et al. Severe vancomycin-induced drug rash with
eosinophilia and systemic symptoms syndrome imitating septic shock. Eur J Anaesthesiol 2009; 26:791.
- Wolfson AR, Zhou L, Li Y, et al. Drug Reaction with Eosinophilia and Systemic Symptoms (DRESS) Syndrome Identified in the Electronic Health Record Allergy Module. J Allergy Clin Immunol Pract 2019; 7:633.
- Konvinse KC, Trubiano JA, Pavlos R, et al. HLA-A*32:01 is strongly associated with vancomycin-induced drug reaction with eosinophilia and systemic symptoms. J Allergy Clin Immunol 2019; 144:183.
- Hung YP, Lee NY, Chang CM, et al. Tolerability of teicoplanin in 117 hospitalized adults with previous vancomycin-induced fever, rash, or neutropenia: a retrospective chart review. Clin Ther 2009; 31:1977.
- An SY, Hwang EK, Kim JH, et al. Vancomycin-associated spontaneous cutaneous adverse drug reactions. Allergy Asthma Immunol Res 2011; 3:194.
- Perrin-Lamarre A, Petitpain N, Trechot P, et al. [Glycopeptide-induced cutaneous adverse reaction: results of an immunoallergic investigation in eight patients]. Ann Dermatol Venereol 2010; 137:101.
- Prey S, Sparsa A, Boumediene A, et al. [Cutaneous drug reactions induced by glycopeptides]. Med Mal Infect 2007; 37:270.
- Cavalcanti AB, Goncalves AR, Almeida CS, et al. Teicoplanin versus vancomycin for proven or suspected infection. Cochrane Database Syst Rev 2010; :CD007022.
- Nousari HC, Costarangos C, Anhalt GJ. Vancomycin-associated linear IgA bullous dermatosis. Ann Intern Med 1998; 129:507.
- Bernstein EF, Schuster M. Linear IgA bullous dermatosis associated with vancomycin. Ann Intern Med 1998; 129:508.
- Bitman LM, Grossman ME, Ross H. Bullous drug eruption treated with amputation. A challenging case of vancomycin-induced linear IgA disease. Arch Dermatol 1996; 132:1289.
- Richards SS, Hall S, Yokel B, Whitmore SE. A bullous eruption in an elderly woman. Vancomycin-associated linear IgA dermatosis (LAD). Arch Dermatol 1995; 131:1447.
- Neughebauer BI, Negron G, Pelton S, et al. Bullous skin disease: an unusual allergic reaction to vancomycin. Am J Med Sci 2002; 323:273.
- Solky BA, Pincus L, Horan RF. Vancomycin-induced linear IgA bullous dermatosis:
morphology is a key to diagnosis. Cutis 2004; 73:65.
- Onodera H, Mihm MC Jr, Yoshida A, Akasaka T. Drug-induced linear IgA bullous dermatosis. J Dermatol 2005; 32:759.
- Mofid MZ, Costarangos C, Bernstein B, et al. Drug-induced linear immunoglobulin A bullous disease that clinically mimics toxic epidermal necrolysis. J Burn Care Rehabil 2000; 21:246.
- Coelho S, Tellechea O, Reis JP, et al. Vancomycin-associated linear IgA bullous dermatosis mimicking toxic epidermal necrolysis. Int J Dermatol 2006; 45:995.
- Park JS, Hamilton CD, Patel S, et al. Linear Immunoglobulin A (IgA) Bullous Dermatosis Mimicking Stevens-Johnson Syndrome. Cureus 2022; 14:e30309.
- Billet SE, Kortuem KR, Gibson LE, El-Azhary R. A morbilliform variant of vancomycin- induced linear IgA bullous dermatosis. Arch Dermatol 2008; 144:774.
- Laurencin CT, Horan RF, Senatus PB, et al. Stevens-Johnson-type reaction with vancomycin treatment. Ann Pharmacother 1992; 26:1520.
- Alexander II, Greenberger PA. Vancomycin-induced Stevens-Johnson syndrome. Allergy Asthma Proc 1996; 17:75.
- Neal D, Morton R, Bailie GR, Waldek S. Exfoliative reaction to vancomycin. Br Med J (Clin Res Ed) 1988; 296:137.
- Vidal C, González Quintela A, Fuente R. Toxic epidermal necrolysis due to vancomycin. Ann Allergy 1992; 68:345.
- Gilmore ES, Friedman JS, Morrell DS. Extensive fixed drug eruption secondary to vancomycin. Pediatr Dermatol 2004; 21:600.
- Felix-Getzik E, Sylvia LM. Vancomycin-induced leukocytoclastic vasculitis. Pharmacotherapy 2009; 29:846.
- Marik PE, Ferris N. Delayed hypersensitivity reaction to vancomycin. Pharmacotherapy 1997; 17:1341.
- Smith PF, Taylor CT. Vancomycin-induced neutropenia associated with fever: similarities between two immune-mediated drug reactions. Pharmacotherapy 1999; 19:240.
- Von Drygalski A, Curtis BR, Bougie DW, et al. Vancomycin-induced immune thrombocytopenia. N Engl J Med 2007; 356:904.
- Christie DJ, van Buren N, Lennon SS, Putnam JL. Vancomycin-dependent antibodies associated with thrombocytopenia and refractoriness to platelet transfusion in patients with leukemia. Blood 1990; 75:518.
- Marraffa J, Guharoy R, Duggan D, et al. Vancomycin-induced thrombocytopenia: a case proven with rechallenge. Pharmacotherapy 2003; 23:1195.
- Reis AG, Grisi SJ. Adverse effects of vancomycin in children: a review of 22 cases. Sao Paulo Med J 1997; 115:1452.
- Black E, Lau TT, Ensom MH. Vancomycin-induced neutropenia: is it dose- or duration- related? Ann Pharmacother 2011; 45:629.
- Labbus K, Junkmann JK, Perka C, et al. Antibiotic-induced fever in orthopaedic patients-a diagnostic challenge. Int Orthop 2018; 42:1775.
- Hazlewood KA, Brouse SD, Pitcher WD, Hall RG. Vancomycin-associated nephrotoxicity: grave concern or death by character assassination? Am J Med 2010; 123:182.e1.
- Vandecasteele SJ, De Vriese AS. Recent changes in vancomycin use in renal failure. Kidney Int 2010; 77:760.
- Welch HK, Kellum JA, Kane-Gill SL. Drug-Associated Acute Kidney Injury Identified in the United States Food and Drug Administration Adverse Event Reporting System Database. Pharmacotherapy 2018; 38:785.
- Wai AO, Lo AM, Abdo A, Marra F. Vancomycin-induced acute interstitial nephritis. Ann Pharmacother 1998; 32:1160.
- Salazar MN, Matthews M, Posadas A, et al. Biopsy proven interstitial nephritis following treatment with vancomycin: a case report. Conn Med 2010; 74:139.
- Codding CE, Ramseyer L, Allon M, et al. Tubulointerstitial nephritis due to vancomycin. Am J Kidney Dis 1989; 14:512.
- Wood MJ. Comparative safety of teicoplanin and vancomycin. J Chemother 2000; 12 Suppl 5:21.
- Svetitsky S, Leibovici L, Paul M. Comparative efficacy and safety of vancomycin versus teicoplanin: systematic review and meta-analysis. Antimicrob Agents Chemother 2009; 53:4069.
- Wilson AP. Comparative safety of teicoplanin and vancomycin. Int J Antimicrob Agents 1998; 10:143.
- Khurana C, de Belder MA. Red-man syndrome after vancomycin: potential cross- reactivity with teicoplanin. Postgrad Med J 1999; 75:41.
- Sahai J, Healy DP, Shelton MJ, et al. Comparison of vancomycin- and teicoplanin- induced histamine release and “red man syndrome”. Antimicrob Agents Chemother 1990; 34:765.
- Sice PJA, Ford S, Whyte AF, Greig JR. Teicoplanin hypersensitivity during anaesthesia and surgery. Br J Clin Pharmacol 2019; 85:854.
- Azamgarhi T, Shah A, Warren S. Teicoplanin anaphylaxis associated with surgical prophylaxis. Br J Clin Pharmacol 2018; 84:1038.
- Savic LC, Garcez T, Hopkins PM, et al. Teicoplanin allergy – an emerging problem in the anaesthetic allergy clinic. Br J Anaesth 2015; 115:595.
- Marshall C, Street A, Galbraith K. Glycopeptide-induced vasculitis–cross-reactivity between vancomycin and teicoplanin. J Infect 1998; 37:82.
- Henson KE, Levine MT, Wong EA, Levine DP. Glycopeptide antibiotics: evolving resistance, pharmacology and adverse event profile. Expert Rev Anti Infect Ther 2015; 13:1265.
- Hahn AW, Jain R, Spach DH. New Approaches to Antibiotic Use and Review of Recently Approved Antimicrobial Agents. Med Clin North Am 2016; 100:911.
- Ishizuka KT, Tran TK, Ayars AG, et al. Graded Dalbavancin Challenge in a Patient With Severe Vancomycin Hypersensitivity Reaction. Clin Infect Dis 2020; 70:1230.
Topic 2083 Version 24.0
© 2023 UpToDate, Inc. All rights reserved.