Trang chủ
-
Therapeutic Monitoring of Vancomycin for Serious Methicillin-resistant Staphylococcus aureus Infections: A Revised Consensus Guideline and Review by the American Society of Health-system Pharmacists, the Infectious Diseases Society of America, the Pediatric

 Clinical Infectious Diseases
Clinical Infectious DiseasesIDS A FEA TURE S
Therapeutic Monitoring of Vancomycin for Serious Methicillin-resistant Staphylococcus aureus Infections: A Revised Consensus Guideline and Review by the American Society of Health-system Pharmacists, the Infectious Diseases Society of America, the Pediatric
Infectious Diseases Society, and the Society of Infectious Diseases Pharmacists
Michael J. Rybak,1,2,3 Jennifer Le,4 Thomas P. Lodise,5 Donald P. Levine,2,3 John S. Bradley,6,7 Catherine Liu,8,9 Bruce A. Mueller,10 Manjunath P. Pai,10 Annie Wong-Beringer,11 John C. Rotschafer,12 Keith A. Rodvold,13 Holly D. Maples,14 and Benjamin Lomaestro15
1Anti-Infective Research Laboratory, Department of Pharmacy Practice, Eugene Applebaum College of Pharmacy and Health Sciences, Wayne State University, Detroit, Michigan, USA, 2School of Medicine, Wayne State University, Detroit, Michigan, USA, 3Detroit Receiving Hospital, Detroit, Michigan, USA, 4Skaggs School of Pharmacy and Pharmaceutical Sciences, University of California, San Diego, La Jolla, California, USA, 5Albany College of Pharmacy and Health Sciences, Albany, New York, USA, 6Department of Pediatrics, Division of Infectious Diseases, University of California, San Diego, La Jolla, California, USA, 7Rady Children’s Hospital San Diego, San Diego, California, USA, 8Division of Allergy and Infectious Diseases, University of Washington, Seattle, Washington, USA, 9Vaccine and Infectious Disease Division, Fred Hutchinson Cancer Research Center, Seattle, Washington, USA, 10University of Michigan College of Pharmacy, Ann Arbor, Michigan, USA, 11University of Southern California School of Pharmacy, Los Angeles, California, USA, 12University of Minnesota College of Pharmacy, Minneapolis, Minnesota, USA, 13University of Illinois College of Pharmacy, Chicago, Illinois, USA, 14University of Arkansas for Medical Sciences College of Pharmacy and Arkansas Children’s Hospital, Little Rock, Arkansas, USA, and 15Albany Medical Center Hospital, Albany, New York, USA
Recent clinical data on vancomycin pharmacokinetics and pharmacodynamics suggest a reevaluation of current dosing and moni- toring recommendations. The previous 2009 vancomycin consensus guidelines recommend trough monitoring as a surrogate marker for the target area under the curve over 24 hours to minimum inhibitory concentration (AUC/MIC). However, recent data suggest that trough monitoring is associated with higher nephrotoxicity. This document is an executive summary of the new van- comycin consensus guidelines for vancomycin dosing and monitoring. It was developed by the American Society of Health-System Pharmacists, the Infectious Diseases Society of America, the Pediatric Infectious Diseases Society, and the Society of Infectious Diseases Pharmacists vancomycin consensus guidelines committee. These consensus guidelines recommend an AUC/MIC ratio of 400–600 mg*hour/L (assuming a broth microdilution MIC of 1 mg/L) to achieve clinical efficacy and ensure safety for patients being treated for serious methicillin-resistant Staphylococcus aureus infections.
Keywords. vancomycin consensus guidelines; vancomycin; pharmacokinetics and pharmacodynamics; target attainment; nephrotoxicity.
EXECUTIVE SUMMARY
The revised vancomycin consensus guidelines for dosing and monitoring vancomycin is an updated version of the 2009 guidelines developed by the American Society of Health- Systems Pharmacists, the Infectious Diseases Society of
America, the Pediatric Infectious Diseases Society, and the Society of Infectious Diseases Pharmacists vancomycin guidelines committee. The following is an executive sum- mary of key recommendations and grading system used for this document (Tables 1, 2) [1, 2].
Despite more than 61 years of clinical use of vancomycin, knowledge gaps regarding the most appropriate approach for
optimizing therapy and minimizing toxicity still exist. The area
Received 12 March 2020; editorial decision 12 March 2020; published online July 13, 2020. Correspondence: M. J. Rybak, Anti-Infective Research Laboratory, Department of Pharmacy
Downloaded from https://academic.oup.com/cid/article/71/6/1361/5870833 by guest on 04 December 2023
Practice, Eugene Applebaum College of Pharmacy, Wayne State University, 259 Mack Ave, Detroit, MI 48201 ([email protected]).
Clinical Infectious Diseases® 2020;71(6):1361–4
© The Author(s) 2020. Published by Oxford University Press for the Infectious Diseases Society of America. All rights reserved. For permissions, e-mail: [email protected].
DOI: 10.1093/cid/ciaa303
under the curve over 24 hours to minimum inhibitory con- centration ratio (AUC/MIC) has been documented as the pri- mary pharmacokinetic/pharmacodynamic (PK/PD) target for glycopeptides, including vancomycin. The previous consensus guidelines in 2009 recommended the use of trough moni- toring (target 15–20 mg/L) as a surrogate marker of the AUC/
Table 1. Grading System for Recommendations Based on Quality of Evidence
Downloaded from https://academic.oup.com/cid/article/71/6/1361/5870833 by guest on 04 December 2023
Category and Grade Definition
Strength of recommendation
A Good evidence to support a recommendation for or against use
B Moderate evidence to support a recommendation for or against use
C Poor evidence to support a recommendation
Quality of evidence
I Evidence from 1 or more properly randomized controlled trials
II
Evidence from 1 or more well-designed clinical trials, without randomization; from cohort or case-controlled analytic studies (preferably from > 1 center); from multiple time-series; or from dramatic results from uncontrolled experiments
III Evidence from opinions of respected authorities, based on clinical experience, descriptive studies, or reports of expert committees
Adapted from the Canadian Task Force on the Periodic Health Examination [2].
Table 2. Primary Recommendations for Vancomycin Dosing and Therapeutic Drug Monitoring
- ADULTS AND PEDIATRICS
1. In patients with suspected or definitive serious MRSA infections, an individualized target of the AUC/MICBMD ratio of 400 to 600 (assuming a vancomycin MICBMD of 1 mg/L) should be advocated to achieve clinical efficacy while improving patient safety (A-II).
2. When transitioning to AUC/MIC monitoring, clinicians should conservatively target AUCs for patients with suspected or documented serious infections due to MRSA assuming a vancomycin MICBMD of 1 mg/L or less at most institutions. Given the importance of early, appropriate therapy, vancomycin targeted exposure should be achieved early during the course of therapy, preferably within the first 24 to 48 hours (A-II). As such, the use of Bayesian-derived AUC
monitoring may be prudent in these cases since it doesn’t require steady-state serum vancomycin concentrations to allow for early assessment of AUC target attainment.
3. Trough-only monitoring, with target between 15 and 20 mg/L, is no longer recommended based on efficacy and nephrotoxicity data in patients with serious infections due to MRSA (A-II). There is insufficient evidence to provide recommendations on whether trough-only or AUC-guided vancomycin monitoring should be used among patients with noninvasive MRSA or other infections.
4. Vancomycin monitoring is recommended for patients receiving vancomycin for serious MRSA infections to achieve sustained targeted AUC (assuming a MICBMD of 1 mg/L, unless it is known to be greater or less than 1 mg/L by BMD). Independent of MRSA infection, vancomycin monitoring is also recom- mended for all patients at high risk of nephrotoxicity (eg, critically ill patients receiving concurrent nephrotoxins), patients with unstable (ie, deteriorating or significantly improving) renal function, and those receiving prolonged courses of therapy (more than 3–5 days). We suggest the frequency of monitoring be based on clinical judgement; frequent or daily monitoring may be prudent for hemodynamically unstable patients (eg, end-stage renal disease) and once- weekly monitoring for hemodynamically stable patients (B-II).
5. Based on current national vancomycin susceptibility surveillance data, under most circumstances for empiric dosing, the vancomycin MIC should be as- sumed to be 1 mg/L. When the MICBMD is > 1 mg/L, the probability of achieving an AUC/MIC ≥ 400 target is unlikely with conventional dosing; higher doses may risk unnecessary toxicity and the decision to change therapy should be based on clinical judgment. In addition, when MICBMD < 1 mg/L, we do not rec- ommend decreasing the dose to achieve the AUC/MIC target. It is important to note the limitations in automated susceptibility testing methods, including the lack of precision and variability in MIC results depending on method used (B-II).
6. The PK of continuous infusion suggest that such regimens may be a reasonable alternative to conventional intermittent infusion dosing when the AUC target cannot be achieved (B-II).
7. Incompatibility with vancomycin and other drugs commonly coadministered in the ICU requires the use of independent lines or multiple catheters when vancomycin is being considered for continuous infusion (A-III).
- ADULTS
- Given the narrow vancomycin AUC range for therapeutic effect and minimal AKI, the most accurate and optimal way to manage vancomycin dosing should be through AUC-guided dosing and monitoring (A-II). We recommend to accomplish this in 1 of 2 ways.
- One approach relies on the collection of 2 concentrations (obtained near steady-state, postdistributional peak concentration at 1–2 hours after infusion and trough at end of dosing interval) preferably but not required during the same dosing interval (if possible) and utilizing first-order PK equations to esti- mate the AUC (A-II).
- The preferred approach to monitor AUC involves the use of Bayesian software programs, embedded with a PK model based on richly sampled vanco- mycin data as the Bayesian prior, to optimize the delivery of vancomycin based on the collection of 1 or 2 vancomycin concentrations, with at least 1 trough. It is preferred to obtain 2 PK samples (ie, 1–2 hours postinfusion and at end of dosing interval) to estimate the AUC with the Bayesian approach (A-II). A trough concentration alone may be sufficient to estimate the AUC with the Bayesian approach in some patients, but more data are needed across different patient populations to confirm viability of using trough only data (B-II).
9. Doses of 15 to 20 mg/kg (based on actual body weight) administered every 8–12 hours as an intermittent infusion are recommended for most patients with
normal renal function when assuming MICBMD of 1 mg/L (A-II). In patients with normal renal function, these doses may not achieve therapeutic AUC/MIC target when the MIC is 2 mg/L.
10. Continuous infusion: Based on current available data, a loading dose of 15-20 mg/kg, followed by daily maintenance CI of 30–40 mg/kg up to 60 mg/kg, to achieve target steady-state concentration of 20–25 mg/L may be considered for critically ill patients (B-II). AUC24 can be simply calculated when multiplying steady-state concentration (ie, desired therapeutic range of 20–25 mg/L throughout entire dosing interval) by a factor of 24 (B-II). Attaining the desired drug exposure may be more readily accomplished given the ease of sampling time and dosage adjustment by changing the rate of infusion which is a highly de- sirable feature in critically ill patients (B-II).
11. The risk of developing nephrotoxicity with continuous infusion appears to be similar or lower compared to intermittent dosing when targeting steady-state concentration 15–25 mg/L and trough 10–20 mg/L, respectively (B-II). Definitive studies are needed to compare drug exposure based on measured AUC24 and factors that predispose to development of nephrotoxicity such as receipt of concomitant nephrotoxins, diuretics, and/or vasopressor therapy in patients receiving continuous infusion vs intermittent infusion of vancomycin.
Table 2. Continued
12. In order to achieve rapid attainment of targeted concentrations in critically ill patients with suspected or documented serious MRSA infections, a loading dose of 20–35 mg/kg can be considered for intermittent administration of vancomycin (B-II). Loading doses should be based on actual body weight and not exceed 3000 mg. More intensive and early therapeutic monitoring should also be performed in obese patients (B-II).
13. Adult obesity: A vancomycin loading dose of 20–25 mg/kg using actual body weight with a maximum of 3000 mg may be considered in obese adult pa- tients with serious infections (B-II). Empiric maintenance doses for most obese patients usually do not exceed 4500 mg/day, depending on their renal function (B-II). Early and frequent monitoring of AUC exposure is recommended for dose adjustment, especially when empiric doses exceed 4000 mg/day (A-II).
14. Intermittent hemodialysis: Since efficacy data are unavailable for AUC < 400 mg*h/L, monitoring based on predialysis serum concentrations and extrapo- lating these values to estimate AUC is most practical. Maintaining predialysis concentrations between 15 and 20 mg/L are likely to achieve the AUC of 400-600 mg*h/L in the previous 24 hours (C-III). Predialysis serum concentration monitoring should be performed not less than weekly and should drive
subsequent dosing rather than a strict weight-based recommendation, although these recommended doses provide a useful starting point until serum con- centrations have been determined (B-II).
15. Hybrid dialysis therapies (eg slow-low efficiency dialysis): Loading doses of 20–25 mg/kg actual body weight should be used, recognizing that these hybrid dialysis therapies efficiently remove vancomycin (B-III). Initial doses should not be delayed to wait for a dialysis treatment to end. Maintenance doses of 15 mg/kg should be given after hybrid hemodialysis ends or during the final 60–90 minutes of dialysis, as is done with standard hemodialysis (B-III). Concentra- tion monitoring should guide further maintenance doses.
16. Continuous renal replacement therapies: Loading doses of 20–25 mg/kg by actual body weight should be used in patients receiving CRRT at conventional, KDIGO-recommended effluent rates of 20-25 mL/kg/h (B-II). Initial maintenance dosing for CRRT with effluent rates of 20–25 mL/kg/h should be 7.5–10 mg/ kg every 12 hours (B-II). Maintenance dose and dosing interval should be based on serum concentration monitoring, which should be conducted within
the first 24 hours to ensure AUC/MIC targets are met. In fluid-overloaded patients, doses may be reduced as patients become euvolemic and drug Vd decreases. The use of continuous infusion vancomycin in patients receiving CRRT appears to be growing, and could be used in place of intermittent vanco- mycin dosing, especially when high CRRT ultrafiltrate/dialysate flow rates are employed (B-II).
- PEDIATRICS
17. Based on an AUC target of 400 mg*h/L (but potentially up to 600 mg*h/L assuming MIC of ≤ 1 mg/L) from adult data, the initial recommended vancomycin dosage for children with normal renal function and suspected serious MRSA infections is 60–80 mg/kg/day, divided every 6 to 8 hours, for children ages 3 months and older (A-II).
18. The maximum empiric daily dose is usually 3600 mg/day in children with adequate renal function (C-III). Most children generally should not require more than 3000 mg/day and doses should be adjusted based on observed concentrations to achieve the AUC/MIC target. Early monitoring of observed concen- trations is recommended when doses exceed 2000–3000 mg/day (A-III). Furthermore, close monitoring of observed concentrations and renal function is prudent in patients with poor or augmented renal clearance as resolution of their renal function may occur within the first 5 days of therapy.
19. AUC-guided therapeutic monitoring for vancomycin, preferably with Bayesian estimation, is suggested for all pediatric age groups, based on developmental changes of vancomycin CL documented from the newborn to the adolescent. Based on current available data, the suggestion for AUC-guided monitoring in pediatrics aligns with the approach for adults, including the application of Bayesian estimation for 1 trough concentration, or first-order PK equations with 2 concentrations (B-II). The Bayesian AUC-guided dosing strategy may be an optimal approach to individualize vancomycin therapy in pediatrics since it can incorporate varying ages, weights, and renal function. Both serum concentrations of vancomycin and renal function should be monitored since vancomycin CL and creatinine CL are not always well correlated in pediatrics. Furthermore, aggressive dosing to maintain target AUC exposure and decrease the risk of potential AKI in treatment of MRSA infection necessitates drug monitoring.
20. Therapeutic monitoring may begin within 24 to 48 hours of vancomycin therapy for serious MRSA infections in children, as in adults (B-III). Any delay in therapeutic monitoring should be based on severity of infection and clinical judgment. Dosing adjustment should be made for those with renal insufficiency, obesity, or for those receiving concurrent nephrotoxic drug therapy. Following the initial dose, dosing adjustment is important for those with acute renal insufficiency, but subsequent adjustment (particularly within the first 5 days of therapy) may be necessary for those experiencing recovery of renal function. Sustained or subsequent decreases in dosage may be needed, particularly for those with chronic renal insufficiency and those receiving concurrent nephro- toxic drug therapy (B-III).
21. Vancomycin exposure may be optimally maintained below the thresholds for AUC of 800 mg*h/L and trough concentrations of 15 mg/L to minimize AKI
(B-II). The safety of vancomycin above 80 mg/kg/day has not been prospectively evaluated. Avoiding vancomycin doses ≥ 100 mg/kg/day is suggested since they are likely to surpass these thresholds (B-III).
22. Insufficient data exist on which to base a recommendation for a loading dose among the nonobese pediatric population. Loading doses from adult studies may be considered, but further studies are needed to elucidate the appropriate dose for the various pediatric populations from the neonate to adolescent (C-III).
23. Pediatric obesity: Data suggest that obese children are likely to have vancomycin exposures that may be statistically greater than normal-weight children when doses are calculated on a mg/kg basis, but these differences are not known to be of sufficient clinical importance to suggest different mg/kg empiric vancomycin dosages in obese children at this time. Similar to nonobese children, obese children < 12 years old, compared with those ≥ 12 years, may re- quire higher mg/kg dose (B-II).
24. Pediatric obesity: Therapeutic monitoring is likely to be of particular value in obese children, both for therapeutic response and the risk of AKI. The specific recommendations for therapeutic monitoring in nonobese children may also apply for obese children (B-II). A loading dose of 20 mg/kg by total body weight is recommended in obese children (A-III).
25. Neonates: Doses recommended to achieve an AUC of 400 mg*h/L (assuming an MIC of 1 mg/L) in neonates and infants up to 3 months old range from 10 to 20 mg/kg every 8 to 48 hours, depending on postmenstrual age, weight, and SCr (A-II).
Abbreviations: AKI, acute kidney injury; AUC, area under the curve; AUC24, area under the curve over 24 hours; CL, clearance; CRRT, continuous renal replacement therapy; ICU, intensive care unit; KDIGO, Kidney Diseases Improving Global Outcomes; MICBMD, minimum inhibitory concentration, broth microdilution; MRSA, methicillin-resistant Staphylococcus aureus; PK, pharmacokinetics; SCr, serum creatinine; Vd, volume of distribution.
MIC (target 400 mg*hour/L) for ease of managing therapy and simplifying dose adjustments and monitoring. At that time, the primary reason for increasing the exposure of vancomycin via specific trough monitoring targets was to improve the
Downloaded from https://academic.oup.com/cid/article/71/6/1361/5870833 by guest on 04 December 2023
likelihood of achieving the AUC/MIC target of 400 mg*hour/L and thereby increasing efficacy. However, since the implemen- tation of these recommendations, there have been numerous reports of increased nephrotoxicity in adults and pediatrics
when trough level monitoring using these targets has been ap- plied. Recent PK/PD and toxicodynamic studies have demon- strated a significantly reduction in vancomycin exposure and nephrotoxicity rates without compromising outcomes when AUC/MIC monitoring has been employed vs traditional trough monitoring approaches.
Downloaded from https://academic.oup.com/cid/article/71/6/1361/5870833 by guest on 04 December 2023
When using AUC/MIC-guided empiric dosing, the MIC should be assumed to be 1 mg/L based on broth microdilution methods, extensive antibiotic susceptibility data, and the in- accuracies or variability of automated susceptibility testing (±1 log2 dilutions). Specific information regarding MIC eval- uation and automated susceptibility testing can be found under the MIC susceptibility section of the full guideline [1]. A target AUC between 400 and 600 mg*hour/L is suggested for methicillin-resistant Staphylococcus aureus (MRSA) invasive infections in adults and pediatrics based on clinical efficacy and safety data. These AUC targets should be achieved early in the course of therapy (24–48 hours) given the importance of early and appropriate therapy. Loading doses based on actual body weight are suggested for patients who are critically ill, requiring renal replacement therapy, or receiving continuous infusion therapy. Specific recommendations for patients with obesity on renal replacement therapy and, for the first time, pediatric pa- tients are now included in the revised guidelines [1].
It should be noted that almost all data available on vanco- mycin PK/PD and toxicodynamics have been derived from pa- tients who have been treated for serious infections of MRSA. Furthermore, the majority of the data have been derived from patients with complicated bloodstream infections. Therefore, caution should be applied when extrapolating this informa- tion to mild noninvasive infections or other bacterial species susceptible to vancomycin. These guidelines conclude that
AUC-guided dosing and monitoring is the most accurate and safest way to dose vancomycin. The recommendations in this document should not circumvent sound clinical judgment in managing patients who require vancomycin therapy. Specific details for each section of the document, including references, can be found in the primary publication [1].
Note
Potential conflicts of interest. T. P. L. is a board member of Motif; is a consultant for Paratek, Melinta, Merck, and Motif; has received grants from Merck and Motif; and is on the speaker’s bureaus of Melinta and Sunovion. B. A. M. has received grants from NxStage and Merck, and personal fees from Wolters-Kluwer. M. P. P. reports personal fees from Paratek and grants from Merck. K. A. R. is a consultant, on the speaker’s bureau, and/or served on advisory boards for the following companies: Achaogen, Allergan, Bayer, BLC USA, Entasis Therapeutics, GSK, Janssen Pharmaceuticals, Meiji, Melinta Therapeutics, Medicine Company, Merck, Motif Bio PLC, Nabriva Therapeutics, Qpex Biopharma, Rempex, Shionogi, Spero Therapeutics, Theravance Biopharma, Tetraphase, Wockhardt, and Zavante Therapeutics; and has received research grants and contracts (paid to the University of Illinois at Chicago) from Theravance Biopharma and Allergan. M. J. R. has received grants and personal fees from Allergan, Melinta, Merck, Motif, Paratek, Shionogi, and Tetraphase; personal fees from InsightRx; and grants from Contrafect. A. W.-B. has received grants from Merck and Allergan, and from Nabriva Therapeutics and Paratek Pharmaceuticals. All other authors report no potential conflicts of interest. All authors have submitted the ICMJE Form for Disclosure of Potential Conflicts of Interest. Conflicts that the editors consider relevant to the con- tent of the manuscript have been disclosed.
References
- Rybak MJ, Le J, Lodise TP, et al. Therapeutic monitoring of vancomycin for serious methicillin-resistant Staphylococcus aureus infections: a revised consensus guideline and review of the American Society of Health-System Pharmacists, the Infectious Diseases Society by America, the Pediatric Infectious Diseases Society, and the Society of Infectious Diseases Pharmacists. Am J Health-Syst Pharm 2020; 77:835–64. doi:10.1093/ajhp/zxaa036
- The periodic health examination. Canadian Task Force on the Periodic Health Examination. Can Med Assoc J 1979; 121:1193–254.
-
Endovascular thrombectomy for acute ischaemic stroke with established large infarct- multicentre, open-label, randomised trial
Articles
Endovascular thrombectomy for acute ischaemic stroke with established large infarct: multicentre, open-label, randomised trial
Martin Bendszus, Jens Fiehler, Fabien Subtil, Susanne Bonekamp, Anne Hege Aamodt, Blanca Fuentes, Elke R Gizewski, Michael D Hill, Antonin Krajina, Laurent Pierot, Claus Z Simonsen, Kamil Zeleňák, Rolf A Blauenfeldt, Bastian Cheng, Angélique Denis, Hannes Deutschmann, Franziska Dorn, Fabian Flottmann, Susanne Gellißen, Johannes C Gerber, Mayank Goyal, Jozef Haring, Christian Herweh, Silke Hopf-Jensen,
Vi Tuan Hua, Märit Jensen, Andreas Kastrup, Christiane Fee Keil, Andrej Klepanec, Egon Kurča, Ronni Mikkelsen, Markus Möhlenbruch, Stefan Müller-Hülsbeck, Nico Münnich, Paolo Pagano, Panagiotis Papanagiotou, Gabor C Petzold, Mirko Pham,Volker Puetz, Jan Raupach,
Gernot Reimann, Peter Arthur Ringleb, Maximilian Schell, Eckhard Schlemm, Silvia Schönenberger, Bjørn Tennøe, Christian Ulfert, Kateĭina Vališ, Eva Vítková, Dominik F Vollherbst, Wolfgang Wick, Götz Thomalla, on behalf of the TENSION Investigators*
Summary
Background Recent evidence suggests a beneficial effect of endovascular thrombectomy in acute ischaemic stroke with large infarct; however, previous trials have relied on multimodal brain imaging, whereas non-contrast CT is mostly used in clinical practice.
Methods In a prospective multicentre, open-label, randomised trial, patients with acute ischaemic stroke due to large vessel occlusion in the anterior circulation and a large established infarct indicated by an Alberta Stroke Program Early Computed Tomographic Score (ASPECTS) of 3–5 were randomly assigned using a central, web-based system (using a 1:1 ratio) to receive either endovascular thrombectomy with medical treatment or medical treatment (ie, standard of care) alone up to 12 h from stroke onset. The study was conducted in 40 hospitals in Europe and one site in Canada. The primary outcome was functional outcome across the entire range of the modified Rankin Scale at 90 days, assessed by investigators masked to treatment assignment. The primary analysis was done in the intention- to-treat population. Safety endpoints included mortality and rates of symptomatic intracranial haemorrhage and were analysed in the safety population, which included all patients based on the treatment they received. This trial is registered with ClinicalTrials.gov, NCT03094715.
Findings From July 17, 2018, to Feb 21, 2023, 253 patients were randomly assigned, with 125 patients assigned to endovascular thrombectomy and 128 to medical treatment alone. The trial was stopped early for efficacy after the first pre-planned interim analysis. At 90 days, endovascular thrombectomy was associated with a shift in the distribution of scores on the modified Rankin Scale towards better outcome (adjusted common OR 2·58 [95% CI 1·60–4·15]; p=0·0001) and with lower mortality (hazard ratio 0·67 [95% CI 0·46–0·98]; p=0·038). Symptomatic intracranial haemorrhage occurred in seven (6%) patients with thrombectomy and in six (5%) with medical treatment alone.
Interpretation Endovascular thrombectomy was associated with improved functional outcome and lower mortality in patients with acute ischaemic stroke from large vessel occlusion with established large infarct in a setting using non- contrast CT as the predominant imaging modality for patient selection.
Funding EU Horizon 2020.
Copyright © 2023 Elsevier Ltd. All rights reserved.
Lancet 2023; 402: 1753–63
Published Online October 11, 2023 https://doi.org/10.1016/ S0140-6736(23)02032-9
See Comment page 1724
*The TENSION Investigators are listed in the appendix
Neuroradiologie (Prof M Bendszus MD, C Herweh MD,
S Bonekamp DVM,
Prof M Möhlenbruch MD,
C Ulfert MD, D F Vollherbst MD), and Neurologie
(Prof P A Ringleb MD,
Prof S Schönenberger MD, Prof W Wick MD), Universitätsklinikum Heidelberg, Heidelberg,
Germany; Klinik und Poliklinik für Neuroradiologische Diagnostik und Intervention (Prof J Fiehler MD,
F Flottmann MD, S Gellißen MD), and Klinik und Poliklinik für Neurologie (B Cheng MD,
M Jensen MD, M Schell MD, E Schlemm MD,
Prof G Thomalla MD), Universitätsklinikum Hamburg-Eppendorf, Hamburg, Germany; eppdata GmbH, Hamburg, Germany (Prof J Fiehler); Service de Biostatistique, Hospices Civils
Introduction
Endovascular thrombectomy in patients with acute ischaemic stroke due to large vessel occlusion is safe and improves the functional outcome when compared with medical treatment alone.1–7 In most studies, this effect has been demonstrated in patients with minimal or moderate infarct size on imaging before endo vascular thrombectomy. Therefore, current guidelines recommend endovascular thrombectomy in patients with an Alberta Stroke Program Early Computed Tomographic Score (ASPECTS; range from 0–10, where smaller values indicate a larger area of infarction) of at least 6.8,9 Patients with larger brain infarcts are frequently excluded from endovascular thrombectomy, even though they constitute up to 25% of ischaemic strokes due to large vessel occlusion in routine clinical practice.10
Three recent trials and a metaanalysis, including patients with a large infarct, suggested a benefit in functional outcome after endovascular thrombectomy compared with medical treatment alone.11–14 Patient inclusion in these trials was based on MRI or volumetry of the infarct core using perfusion CT, either entirely or in substantial patient subgroups. These trials either represented selected patient populations in Asia or included patients based on criteria
de Lyon, Lyon, France
(F Subtil PhD, A Denis MSc); Laboratoire de Biométrie et Biologie Évolutive, Université de Lyon, Villeurbanne, France (F Subtil, A Denis); Department of Neurology (A H Aamodt MD), and Department of Neuroradiology (B Tennøe MD), Oslo University Hospital, Oslo, Norway; Department of Neurology and Stroke Center, Hospital La Paz Institute for Health Research—
La Paz University
Hospital-Universidad Autonoma de Madrid, Madrid, Spain (Prof B Fuentes MD);
Department of Neuroradiology, Medical University Innsbruck,
Innsbruck, Austria (Prof E R Gizewski MD); Department of Clinical Neurosciences, Hotchkiss Brain Institute, Health Science Centre, University of Calgary & Foothills Medical Centre,
Calgary, AB, Canada
(Prof M D Hill MD, Prof M Goyal PhD); Department of Radiology (Prof A Krajina MD, Prof J Raupach MD), and Department of Neurology
(E Vítková MD), Faculty of Medicine in Hradec Kralove,
Charles University, Czech Republic; Department of
Neuroradiology
(Prof L Pierot MD PhD, P Pagano MD), and Department of Neurology (V T Hua MD), Hôpital Maison-Blanche, Université Reims-Champagne- Ardenne, Reims, France;
Department of Neurology (Prof C Z Simonsen MD, R A Blauenfeldt MD), and
Department of Neuroradiology (R Mikkelsen MD), Aarhus University Hospital, Aarhus, Denmark; Clinic of Radiology (Prof K Zeleňák MD), and Clinic of Neurology (Prof E Kurča MD), Jessenius Faculty of Medicine, Comenius University, Martin,
Slovakia; Division of Neuroradiology, Vascular and Interventional Radiology, Department of Radiology, Medical University Graz,
Graz, Austria (Prof H Deutschmann MD); Klinik für Diagnostische und
Interventionelle Neuroradiologie, Universitätsklinikum Bonn,
Bonn, Germany (Prof F Dorn MD); Institute of Neuroradiology (J C Gerber MD),
Department of Neurology (Prof V Puetz MD), and Dresden Neurovascular Center
(J C Gerber, Prof V Puetz), Universitätsklinikum Carl Gustav Carus an der Technischen Universität Dresden, Dresden, Germany;
Department of Neurology
(J Haring MD), and Department of Radiology (Prof A Klepanec MD), Faculty Hospital Trnava, Trnava, Slovakia; Institut für Diagnostische und Interventionelle Radiologie
Research in context Evidence before this study
We searched PubMed for randomised trials using the search terms “randomised trial” OR “randomized trial” AND “thrombectomy” AND “large core” OR “large infarct” OR “low ASPECTS” for randomised clinical trials published between database inception and Aug 31, 2023. We identified three trials of endovascular thrombectomy versus medical treatment in adults with acute ischaemic stroke and large vessel occlusion presenting with extended infarct. The RESCUE-Japan LIMIT trial randomly assigned 203 patients in Japan with acute ischaemic stroke and large vessel occlusion and a large ischaemic region, reflected by an Alberta Stroke Program Early Computed Tomographic Score (ASPECTS) of 3–5, to endovascular thrombectomy or medical management alone. Most patients (86%) were enrolled based on MRI with assessment of the ischaemic region by diffusion-weighted imaging (DWI).
Patients assigned to endovascular thrombectomy had better functional outcomes than those assigned to medical management alone. The ANGEL-ASPECT trial randomly assigned 456 patients in China with stroke from large vessel occlusion and large infarct, defined by ASPECTS 3–5, or infarct core-volume of 70–100 mL, based on perfusion imaging to endovascular thrombectomy or medical management alone, and observed better functional outcome with endovascular thrombectomy. The international SELECT2 trial randomly assigned 352 patients with acute ischaemic stroke and large vessel occlusion who had a large ischaemic core, defined by ASPECTS 3–5, or core volume of at least 50 mL on perfusion CT or DWI and reported better functional outcomes with endovascular thrombectomy than with medical management alone. In all three trials, patient enrolment was either entirely or in substantial patient subgroups based on MRI or perfusion CT involving commercial software for post-processing. Patient
related to advanced imaging and postprocessing techniques, which limits generalisability to other populations. However, management of acute stroke in clinical practice worldwide frequently relies on visual evaluation of early ischaemic signs predominantly on unenhanced CT, supplemented by CT angiography (CTA) to determine the site of vessel occlusion.15,16
In a randomised trial including patients with a large infarct on admission, we aimed to assess whether endovascular thrombectomy improves functional outcome in acute stroke due to large vessel occlusion. Patient inclusion was in an extended time window of 12 h and based on clinical standard imaging with exclusively visual image assessment using either plain CT or MRI depending on local standards.
Methods
Study design and participants
TENSION (The Efficacy and Safety of Thrombectomy in Stroke with extended lesion and extended time window)
management for acute stroke in clinical practice worldwide mostly relies on visual evaluation of early ischaemic signs, predominantly on unenhanced CT, supplemented by CT angiography to determine the site of vessel occlusion.
Moreover, two of the trials were exclusively done in Japan and China. Thus, the generalisability of the findings from these three trials to other populations is limited.
Added value of this study
TENSION was the first clinical trial to randomly assign patients with acute ischaemic stroke due to large vessel occlusion in the anterior circulation and a large infarct without the use of extended imaging and based on standard-of-care stroke imaging, which was non-contrast CT in 82% of patients and MRI in 18%. Patients were randomly assigned to receive either endovascular thrombectomy or medical treatment (standard of care) alone up to 12 h after stroke onset. At 90 days, there was a shift in the distribution of scores on the modified Rankin Score towards better outcomes in favour of endovascular thrombectomy.
Mortality was lower with endovascular thrombectomy, which also represents a novel finding not observed in the previous trials of thrombectomy for stroke patients with large core. There were no safety concerns with endovascular thrombectomy.
Implications of all the available evidence
Taken together, the published trials provide strong evidence for the benefit of endovascular thrombectomy in patients with acute ischaemic stroke from large vessel occlusion, who present with a large ischaemic region. Patients with acute ischaemic stroke with large infarct achieved a better functional outcome and had a higher probability of survival with endovascular thrombectomy than with medical treatment alone.
Endovascular thrombectomy in these patients could be guided by non-contrast CT, MRI, or perfusion imaging.
was an investigatorinitiated, randomised, openlabel, blinded endpoint, twoarm, postmarket trial in Europe and Canada. The trial was conducted in 40 hospitals in Europe (four sites in Austria, four sites in Czech Republic, two sites in Denmark, four sites in France, 20 sites in Germany, three sites in Norway, two sites in Slovakia, and one site in Spain) and one site in Canada (appendix p 14). An academic steering committee designed and supervised the trial supported by an independent data monitoring and safety committee, ethics advisory board, and scientific advisory board. The protocol has been published and the trial was approved by the institutional review board of the University of Heidelberg and all participating sites.17 Informed consent by the patients or legal representatives was obtained before enrolment into the trial.
All patients underwent a standardised imaging protocol, including unenhanced CT and CTA or MRI including diffusionweighted imaging (DWI) and magnetic resonance angiography (MRA), according to institutional preference. Patients were eligible if they
presented with acute ischaemic stroke due to focal occlusion in the M1 segment of the middle cerebral artery or the intracranial segment of the distal internal carotid artery (ICA) on CTA or MRA, and if they had an ASPECTS of 3–5 on unenhanced CT or DWI, as assessed locally. Patients were randomly assigned within 11 h of symptom onset or last known to be well, with expected completion of endovascular thrombectomy within 12 h. Eligible patients were aged 18 years or older, had a maximum US National Institutes of Health Stroke Scale (NIHSS) score of less than 26 (with scores ranging from 0 to 42 and higher scores indicating worse neurological deficits), and were premorbidly independent, which was defined as a historically estimated score of 0–2 on the modified Rankin Scale (mRS; scores range from 0 to 6, with 0 indicating no disability, 1 no clinically significant disability, 2 slight disability, 3 moderate disability but able to walk unassisted, 4 moderately severe disability,
5 severe disability, and 6 death). Imaging exclusion criteria were known vascular disease preventing endovascular thrombectomy or highgrade extracranial stenosis expected to require acute stent placement and any acute intracranial bleeding or mass effect. A full list of inclusion and exclusion criteria is provided in the protocol (appendix pp 39–154). Information on sex (male or female) was collected by selfreport or medical records.
Randomisation and masking
Patients were randomly assigned to undergo endovascular thrombectomy in addition to medical treatment or to receive medical treatment (standard of care) alone. Randomisation was stratified by time from symptom onset or last known well (<6 h and 6–11 h) and stroke severity (NIHSS ≤18 and NIHSS 19–25) to assure randomised balance within these key prognostic variables. Patients were randomly assigned in a 1:1 ratio using a central, webbased module, with a permuted block design (random block sizes of two and four). All followup examinations were conducted by investigators or trial personnel masked to the patients’ group assignment (ie, personnel not involved in random assignment and treatment of patients and unaware of the randomisation results).
Procedures
The technique of endovascular thrombectomy (ie, stent retriever, aspiration, or both, with or without balloon protection) was left to the discretion of the treating physician. Medical management of patients in both groups was done according to national and international guidelines, including intravenous thrombolysis if indicated.8,9
Clinical assessment was done at baseline, at 24 (±6) h, at 7 days or hospital discharge, and at 90 (±14) days. Baseline disease characteristics included prestroke mRS, presenting symptoms, and stroke severity according to the NIHSS. Followup assessment additionally included
patientreported outcome measures of healthrelated quality of life (EuroQol5 Dimension [EQ5D] and Patient Reported Outcomes Measurement Information System 10item [PROMIS10]) and anxiety and depression (Patient Health Questionnaire4 [PHQ4]). Examinations were conducted by trained, certified investigators masked to the patients’ group assignment. If inperson assessment at 90 days was not possible, a telephone interview was done to assess the mRS. All patients underwent a standardised imaging protocol at baseline, including unenhanced CT supplemented by CTA or MRI with DWI and MRA. Rating of ASPECTS for trial inclusion was determined at the respective site on unenhanced CT images or DWI. Before site initiation, all investigators did webbased ASPECTS training.18 All imaging data were transferred to a central core lab (Eppdata, Hamburg, Germany) and assessed masked to the group assignment.
Outcomes
The primary outcome was functional neurological disability scored on the mRS at 90 (±14) days. The primary endpoint was the difference across the entire range of the mRS at 90 (±14) days between groups in ordinal analysis (shift analysis) in the intentiontotreat population. Secondary outcomes included independent (mRS ≤2) and moderate (mRS ≤3) functional outcome, functional health status and quality of life evaluated by the EQ5D and PROMIS10 questionnaires, poststroke anxiety and depression evaluated by the PHQ4 questionnaire, all assessed at 90 (±14) days after stroke, and rates of decompressive craniectomy, assessed during inhospital treatment.
Safety endpoints comprised death or dependency 90 (±14) days after stroke (mRS 4–6), rates of symptomatic intracranial haemorrhage and parenchymal haemorrhage type 2 at 24 (±6) h,19 frequencies of adverse and serious adverse events, mortality rates at discharge and 90 (±14) days posttreatment, strokerelated death, rates of spaceoccupying infarction, and new ischaemic strokes. Symptomatic intracranial haemorrhage was centrally adjudicated and defined as an increase in the NIHSS score of 4 or more points or an increase in the score for an NIHSS subcategory of 2 or more points as compared with baseline or the lowest value before deterioration, with the presence of parenchymal haemorrhage type 2. Parenchymal haemorrhage type 2 was defined as an intracranial haemorrhage that involved more than 30% of the infarcted area with a substantial spaceoccupying effect or that was remote from the original infarcted area19 and was assessed by the image core lab. Imaging endpoints included core infarct volume (mL) at 24 (±6) h after randomisation. For the endovascular thrombectomy group, we also assessed the rate of embolisation, either distal to the target occlusion or to previously unaffected territories. Restoration of flow was centrally evaluated using the modified Thrombolysis in Cerebral Ischemia (mTICI) scale, a 6point scale
und Neuroradiologie, DIAKO Krankenhaus gGmbH,
Flensburg, Germany
(S Hopf-Jensen MD,
Prof S Müller-Hülsbeck MD);
Klinik für Neurologie
(Prof A Kastrup MD), and Klinik für Diagnostische und Interventionelle Neuroradiologie
(Prof P Papanagiotou MD), Klinikum Bremen Mitte, Bremen, Germany; Institut für Neuroradiologie, Universitätsklinikum Frankfurt, Frankfurt am Main, Germany (C F Keil MD); Klinikum Dortmund gGmbH, Klinikum der Universität Witten/Herdecke, Dortmund, Germany (N Münnich MD,
G Reimann MD); Department of Radiology, Aretaieion University Hospital, National and Kapodistrian University of Athens, Athens, Greece
(Prof P Papanagiotou); Vascular Neurology Research Group, German Center for Neurodegenerative Diseases (DZNE), Bonn, Germany
(Prof G C Petzold MD); Division of Vascular Neurology, Department of Neurology, University Hospital Bonn,
Bonn, Germany
(Prof G C Petzold); Institut für Diagnostische und Interventionelle Neuroradiologie, Universitätsklinikum Würzburg, Würzburg, Germany (Prof M Pham MD); St Anne’s University Hospital Brno, Brno, Czech Republic (K Vališ MD)
Correspondence to:
Prof Götz Thomalla, Klinik und Poliklinik für Neurologie, Universitätsklinikum Hamburg- Eppendorf, Hamburg 20246,
Germany
See Online for appendix
ranging from 0 to 3, on which higher scores indicate greater reperfusion and successful reperfusion was defined as mTICI 2b or better.
Statistical analysis
For the sample size calculation, simulations were done using an assumption for the possible true distribution of mRS from the literature18 and a proportional odds alternative with an odds ratio of 1·5 to be assessed using the primary endpoint mRS shift analysis. Under the assumption of these distributions, a total of 620 patients were required to achieve a power of 80% for a onesided test at the 0·025 level. Assuming a 5% dropout rate of patients to assess the primary endpoint obtained 90 days after inclusion, an effective sample size of 665 was necessary. The study included two interim analyses after a third and twothirds of the patients had completed the 90day followup, for futility and early efficacy (see statistical analysis plan, appendix pp 155–220).
We did efficacy analyses in the intentiontotreat population and in the perprotocol population as sensitivity analysis for the primary endpoint. The intentiontotreat population included all patients who were randomly assigned to a trial group. The perprotocol population included all patients who received the assigned treatment and had no clinically meaningful deviations from the protocol, also excluding all patients in whom central evaluation of baseline images resulted in an ASPECTS value less than 3 or more than 5. We did
safety analyses in the safety population, which included all patients based on the treatment they received. In the safety analysis, the endovascular thrombectomy group included all patients in whom endovascular thrombectomy was initiated and groin puncture was attempted, including patients receiving endovascular thrombectomy outside the trial protocol. All patients in whom no endovascular thrombectomy was initiated were allocated to the medical treatment group.
For the primary efficacy outcome, we used a proportionalodds logistic regression model with adjustments for the randomisation stratification factors; mRS scores 0 and 1 were merged due to the very low numbers in the best medical treatment group. The proportional odds assumption was fulfilled, hence the effect size was quantified by the common odds ratio (OR; likelihoodratio test) with the Wald 95% CI. Missing mRS values at 90 days were imputed (multiple imputation with five imputed datasets, combined using the Rubin’s method) based on a proportionalodds logistic regression model including baseline age, baseline NIHSS, treatment group, and NIHSS at hospital discharge, with the full conditional specification method, under the missingatrandom assumption, except for patients who died before 90 days, for whom a mRS score of 6 was assigned. In addition, we did sensitivity analyses including bestcase and worstcase scenarios. We analysed the primary outcome in prespecified subgroups, by adding an interaction term
125 assigned to receive endovascular thrombectomy plus medical management in the intention-to-treat population 124 had information on mRS at 90 days
28 excluded from per-protoc 27 failed to meet inclusio 1 randomly assigned 1 pre-stroke mRS >2
- active participant
- infective endocardi
Figure 1: Randomisation and analyses
ol analyses n criteria
>11 h after stroke onset
in another trial tis
22 core lab ASPECTS value out of range
1 proximal ICA occlusion requiring stenting 1 met imaging exclusion criteria
1 imaging indicative of a high risk of SICH
128 assigned to receive medical management alone in the intention-to-treat population
121 had information on mRS at 90 days
253 patients randomly assigned
89 assigned to receive medical management alone and included in the per-protocol population
97 assigned to receive endovascular thrombectomy plus medical management and included in the per-protocol population
39 excluded from per-protocol analyses 37 failed to meet inclusion criteria
3 randomly assigned >11 h after stroke onset 1 NIHSS score >26
3 pre-stroke mRS >2
1 occlusion not deemed accessible to the thrombectomy device
28 core lab ASPECTS value out of range
1 core lab ASPECTS evaluation not possible due to missing images
3 protocol deviations
3 received thrombectomy outside the trial protocol
The intention-to-treat population included all the patients who were randomly assigned to a trial group. The per-protocol population included all the patients who had undergone randomisation, who had received treatment as assigned, and who had not been excluded because of a major protocol violation. ASPECTS values range from 0 to 10, with lower scores indicating larger infarction; NIHSS scores range from 0 to 42, with higher scores indicating greater neurological deficit; and mRS values range from 0 (no symptoms) to 6 (death). Numbers of patients excluded from the per-protocol analysis might not add up due to individual patients with multiple exclusion criteria. ASPECTS=Alberta Stroke Program Early Computed Tomographic Score. NIHSS=National Institutes of Health Stroke Scale. mRS=modified Rankin Scale. SICH=symptomatic intracranial haemorrhage.
Sex
Female Male
56 (45%)
59 (55%)
67 (52%)
51 (48%)
Median interval between symptom onset and groin puncture (IQR), h
4·2 (3·4–5·9)
··
Anaesthesia performed (%), n/N Conscious sedation or none
General anaesthesia
69/123 (56%)
54/123 (44%)
··
··
Median age (IQR), years
Endovascular thrombectomy (N=125)
73 (65–81)
Medical treatment (N=128)
74 (64–80)
Median NIHSS score at hospital arrival (IQR)*
19 (16–22)
18 (15–22)
Level of consciousness on hospital arrival (%), n/N Fully awake
Somnolent
Coma
76/123 (62%)
44/123 (36%)
3/123 (2%)
79/126 (63%)
45/126 (36%)
2/126 (2%)
Transfer to centre with endovascular thrombectomy capabilities 70 (56%)
76 (59%)
Median interval between symptom onset and randomisation for known onset strokes (IQR), h
2·0 (1·2–3·5)
2·1 (1·2–3·6)
Median interval between randomisation and recanalisation (IQR), h
2·4 (1·8–3·0)
··
(Table 1 continues on next page)
Symptom onset known 73 (58%) 71 (56%)
Median pre-stroke modified Rankin Scale (IQR)† 0 (0–1) 0 (0–1)
between the treatment group and the baseline characteristics into the main model.
We analysed differences in the secondary binary outcomes between the groups by a logistic regression model, adjusted for randomisation stratification factors, and quantified by OR with the associated 95% CIs, or Fisher tests. For the outcome of death within 90 days, a Cox proportionalhazards model with the same adjustments as previous models was used to estimate the hazard ratio (HR) with the 95% CI; proportionality for this analysis was confirmed. The infarct volume at 24 h was compared between groups with a loglinear model.
Some secondary outcomes are not available because calculations have not been completed (difference of infarct volume at 24 h from infarct volume as predicted by pretreatment imaging), or because not all patients have completed the 12month followup period (functional neurological outcome assessed by the simplified mRS questionnaire, patientreported functional health status and quality of life, and poststroke depression and anxiety at 12 months after stroke). These will be reported in a followup publication.
Medical history (selected; %), n/N Previous ischaemic stroke 11/115 (10%) 18/118 (15%) Hypertension 99/123 (80%) 98/121 (81%) Diabetes 27/119 (23%) 29/121 (24%) Dyslipidaemia 43/115 (37%) 44/115 (38%) Atrial fibrillation 31/117 (26%) 48/118 (41%) Myocardial infarction 14/114 (12%) 17/117 (15%) Heart failure 16/113 (14%) 16/114 (14%) Coronary artery disease 34/116 (29%) 26/115 (23%) Extracranial carotid artery disease 8/115 (7%) 7/113 (6%) Occlusion site (%), n/N Internal carotid artery 41/125 (33%) 37/127 (29%) Middle cerebral artery, M1 segment‡ 83/125 (66%) 88/127 (69%) Middle cerebral artery, M2 segment‡ 0/125 (0%) 1/127 (1%) Middle cerebral artery plus anterior cerebral artery 1/125 (1%) 1/127 (1%) Additional extracranial internal carotid artery occlusion (ie, tandem occlusion) 8 (6%) 7 (5%) Imaging method used for enrolment CT 104 (83%) 104 (81%) MRI 21 (17%) 24 (19%) ASPECTS value (local evaluation for randomisation)§ 3 36 (29%) 48 (38%) 4 45 (36%) 39 (30%) 5 44 (35%) 41 (32%) ASPECTS value (core lab evaluation)§ 0–2
15/125 (12%) 23/127 (18%) 3–5 103/125 (82%) 99/127 (78%) 6–10 7/125 (6%) 5/127 (4%) Intravenous alteplase administered 49 (39%) 44 (34%) Because the statistical analysis plan, available with the protocol, did not include a provision for correcting for the secondary outcomes or multiple comparisons in the subgroup analyses, the CIs should not be used for hypothesis testing. Statistical analyses were done using SAS (version 9.4). This trial was monitored by an independent data and safety monitoring board. This trial is registered at ClinicalTrials.gov, NCT03094715.
Role of the funding source
The funder of the study had no role in study design, data collection, data analysis, data interpretation, or writing of the report.
Results
From July 17, 2018, to Feb 21, 2023, 253 patients were randomly assigned. We stopped the trial early after the boundaries for efficacy were crossed at the first interim analysis on Feb 21, 2023, when 222 patients had reached the primary outcome (appendix p 17, 24). Followup was continued for all patients who had been randomly
assigned, and we report the results for the entire included population. Of 253 patients randomised, 125 (49%) were assigned to receive endovascular thrombectomy plus medical treatment, and 128 (51%) were assigned to receive medical treatment alone (figure 1). Three patients assigned to medical treatment alone received thrombectomy outside the trial protocol. Thus, 128 patients who received thrombectomy and 125 patients who received medical treatment alone were included in the safety population. For the perprotocol analysis, 28 patients from the thrombectomy group and 39 patients from the medical treatment group were excluded. Thus, 97 patients who received thrombectomy and 89 patients who received medical treatment alone were included in
Endovascular Medical treatment thrombectomy (N=128)
(N=125)
(Continued from previous page)
Type of device used for thrombectomy (%), n/N Aspiration catheter alone
Stent retriever alone
Both aspiration catheter and stent retriever Median attempts for thrombectomy (IQR), n
21/121 (17%)
28/121 (23%)
72/121 (60%)
3·0 (2·0–5·0)
··
··
··
··
Data are n (%) unless specified. NIHSS=National Institutes of Health Stroke Scale. *Scores on the National Institutes of Health Stroke Scale with scores ranging from 0 to 42 and higher scores indicating greater neurological deficit. †Scores on the modified Rankin scale range from 0 to 6, with higher scores indicating greater disability. ‡The M1 segment is the main trunk of the middle cerebral artery and the M2 segment is the first-order branch of the main trunk of the middle cerebral artery. §Alberta Stroke Program Early Computed Tomography Score (ASPECTS) values range from 0 to 10, with lower values indicating larger infarction.
Table 1: Demographic and clinical characteristics of participants at baseline and treatment
Score on the Modified Rankin Scale at 90 days
0–1 2 3 4 5 6
Endovascular treatment 8·1 8·9 14·5
19·4
12·1
37·1
Medical treatment 10·7 13·1
19·7
54·1
0·8
1·6
0 10 20 30 40 50 60 70 80 90 100
Proportion of patients (%)
Figure 2: Distribution of Modified Rankin Scale scores at 90 days
Intention-to-treat population analysis. A score of 0 on the modified Rankin Scale indicates no symptoms, a score of 1 indicates no clinically significant disability, a score of 2 indicates slight disability, a score of 3 indicates
moderate disability, a score of 4 indicates moderately severe disability, a score of 5 indicates severe disability, and a score of 6 indicates death. Information on the primary outcome measure was missing in one patient in the endovascular thrombectomy group and six patients in the medical treatment group. Missing values were imputed.
the perprotocol population. Data on the primary outcome were missing for seven patients (one in the thrombectomy group and six in the medical treatment group). Among survivors, information on followup at 90 days was collected by inperson assessment in 28 (36%) of 78 patients assigned to endovascular thrombectomy and 13 (22%) of 58 patients assigned to medical treatment and by telephone interview in 50 (64%) of 78 patients assigned to endovascular thrombectomy and 45 (78%) of 58 patients assigned to medical treatment.
The main baseline demographic and clinical characteristics of the patients were similar in the trial groups (table 1). Across both groups, the median age of patients was 74 (IQR 65–80) years, and 123 (49%) of 253 were women. The median NIHSS score at baseline was 19 (IQR 16–22) for patients in the endovascular thrombectomy group and 18 (15–22) in the medical treatment group. Baseline ASPECTS was assessed based on noncontrast CT in 104 (83%) of 125 patients in the
endovascular thrombectomy group and 104 (81%) of 128 patients in the medical treatment group. There was an imbalance in baseline ASPECTS, as assessed by the image core lab with a larger proportion of patients in the medical treatment group presenting with a low ASPECTS of 0–2 (23 [18%] of 127 patients in the medical treatment only group vs 15 [12%] of 125 patients in the endovascular thrombectomy group).
CT was used as an imaging modality for enrolment in
208 (82%) of 253 patients. In the endovascular thrombectomy group, vessel occlusion was located in the ICA in 41 (33%) of 125 patients and in the M1 segment of the middle cerebral artery (MCA) in 84 (67%) patients. In the medical treatment group, vessel occlusion was present in the ICA in 37 (29%) of 127 patients, in the M1 segment of the MCA in 89 (70%) patients, and in the M2 segment of the MCA in one patient (1%). In the endovascular thrombectomy group, 36 (29%) of
125 patients had an ASPECTS of 3, 45 (36%) had ASPECTS 4, and 44 (35%) had ASPECTS 5. Distribution in the medical treatment group was 48 (38%) with ASPECTS 3, 39 (30%) with ASPECTS 4, and 41 (32%) with ASPECTS 5. Intravenous alteplase was given in
49 (39%) patients in the endovascular thrombectomy group and 44 (34%) patients in the medical treatment group.
In the primary outcome analysis including all 253 patients who had been randomly assigned, there was a shift in the distribution of scores on the mRS at 90 days towards better outcomes in favour of endovascular thrombectomy versus medical treatment alone (adjusted common OR 2·58 [95% CI 1·60–4·15]; p=0·0001; figure 2, table 2, appendix p 25). At the time of the interim analysis including 222 patients, there was a shift in the distribution of scores on the mRS at 90 days towards better outcomes with endovascular thrombectomy (OR 3·05 [2·5% lower CI 1·82]; p<0·0001; appendix p 24).
In the secondary outcome analysis, 21 (17%) of 124 patients in the endovascular thrombectomy group achieved a score of 0–2 on the mRS at 90 days as compared with three (2%) of 122 patients in the medical treatment group (adjusted OR 7·16 [95% CI 2·12–24·21; p=0·0016; appendix p 31). 39 (31%) of 124 patients in the endovascular thrombectomy group had a score of 0–3 on the mRS at 90 days versus 16 (13%) of 122 in the medical treatment group (adjusted OR 2·84 [95% CI 1·48–5·47]; p=0·0018; appendix p 31).
Analysis of patientreported outcomes revealed higher PROMIS10 values for physical health (median T score 39·8 [IQR 34·9–50·8] vs 34·9 [29·6–37·4]; p<0·0008) and mental health (median T score 43·5 [IQR 36·3–50·8] vs 38·8 [32·6–43·5]; p=0·025) at 90 days in patients assigned to endovascular thrombectomy as compared with those assigned to medical treatment.
In the safety population, death at 90 days occurred in
49 (40%) of 122 patients receiving endovascular thrombectomy and 63 (51%) of 123 patients receiving
Primary outcome
Endovascular thrombectomy (N=125)
Medical treatment (N=128)
Treatment effect (95% CI)
p value
Median score on modified Rankin Scale at 90 (±14; IQR) days (%)* 4 (3–6) 6 (4–6) 2·58 (1·60–4·15) 0·0001
Secondary outcomes
Independent neurological outcome (mRS ≤2) at 90 (±14) days (%), n/N 21/124 (17%) 3/122 (2%) 7·16 (2·12–24·21) 0·0016 Moderate neurological outcome (mRS ≤3) with 90 (±14) days (%), n/N 39/124 (31%) 16/122 (13%) 2·84 (1·48–5·47) 0·0018 Decompressive craniotomy 11 (9%) 9 (7%) ·· 0·65
Successful recanalisation (mTICI 2b or better)† 104 (83%) ·· 83% (76–89) ··
Distal embolisation‡ 4 (3%) ·· 3% (1–8) ·· Mean infarct volume at 24 (±6) h (CT or MRI) after randomisation (SD), mL§ 205·8 (139·1) 227·7 (107·2) 0·93 (0·80–1·08) 0·35 Median EQ-5D index at 90 (±14) days (IQR) 0·6 (0·3–0·9) 0·4 (0·2–0·6) ·· 0·0060
Median health status VAS at 90 (±14) days (IQR) 50 (30–70) 40 (20–58) ·· 0·13 Median PROMIS-10 physical health at 90 (±14) days, T-score (IQR) 39·8 (34·9–50·8) 34·9 (29·6–37·4) ·· 0·0008 Median PROMIS-10 mental health at 90 (±14) days (IQR), T-score 43·5 (36·3–50·8) 38·8 (32·6–43·5) ·· 0·025 PHQ-4 anxiety (%), n/N 12/52 (23%) 18/35 (51%) ·· 0·011
PHQ-4 depression (%), n/N 14/52 (27%) 11/35 (31%) ·· 0·81
Data are n (%) unless specified. The treatment effect was reported for the primary outcome as OR (95% CI) for the ordinal shift in the distribution of scores on the modified Rankin Scale towards a better outcome with imputation of missing values. Infarct volume at 24 h after randomisation was reported as coefficient from an adjusted log-linear model. PROMIS-10 and EQ-5D were reported as Wilcoxon rank sum test. Other outcomes were reported as the adjusted OR (95% CI) or as Fisher’s exact test for small numbers. The rate of successful restoration of flow of the occluded target arterial vessel, defined as mTICI 2b or better, was reported descriptively for the group that received thrombectomy with 95% CIs based on the Wald method. The rate of embolisation, either distal to the target occlusion or to previously unaffected territories, was reported descriptively for the group that received thrombectomy with 95% CIs based on the Clopper-Pearson method. The CIs for the secondary outcomes were not adjusted for multiple comparisons and can not be used for hypothesis testing. EQ-5D=EuroQol-5 Dimensions questionnaire. PHQ-4=poststroke anxiety and depression evaluated by the Patient Health Questionnaire-4. PROMIS 10=Patient-Reported Outcomes Measurement Information System 10-item. VAS=visual analogue scale. *Scores on the modified Rankin Scale range from 0 to 6, with higher scores indicating greater disability. †Successful reperfusion was defined as grade 2b to 3 on the modified Thrombectomy in the Cerebral Ischemia system ranging from 0–3, with higher grades indicating increased reperfusion; grade 2b indicates reperfusion of ≥50% of the occluded middle cerebral artery territory; and grade 3 indicates reperfusion of 100% of the occluded middle cerebral artery territory at the end of the thrombectomy procedure. ‡Assessed by the image core lab. §Mean infarct volume was assessed using CT in 101 (83%) of 121 patients assigned to endovascular thrombectomy and 96 (85%) of 113 patients assigned to medical treatment.
Table 2: Efficacy outcomes (intention-to-treat population)
medical treatment alone. Endovascular thrombectomy was associated with lower mortality (HR for death censored at 90 days 0·67 [95% CI 0·46–0·98]; p=0·038; figure 3 and table 3). Death or dependency (modified Rankin Scale 4–6) at 90 days was observed in 88 (69%) of 127 patients receiving endovascular thrombectomy and in 103 (87%) of 119 patients receiving medical treatment only (adjusted OR 0·34 [95% CI 0·18–0·65]; p=0·0011; appendix p 33).
1·0
0·9
0·8
0·7
0·6
0·5
0·4
0·3
0·2
0·1
0
Medical care
Thrombectomy
HR 0·67 (95% CI 0·46–0·98) p=0·038
0 10 20 30 40 50 60 70 80 90
Number at risk
Days since randomisation
Probability of survival
Symptomatic intracranial haemorrhage occurred in seven (5%) of 128 of patients given endovascular thrombectomy and in six (5%) of 125 given medical treatment alone. Parenchymal haemorrhage type 2 was observed in 11 (9%) patients receiving endovascular
endovascular thrombectomy, at least one serious adverse event was reported in 71 patients (56%), compared with
thrombectomy and ten (9%) patients receiving medical Medical care 125 82 68 66 64 63 63 62 60 60 treatment (appendix p 33). In patients receiving Thrombectomy 128 96 87 83 82 81 80 80 79 73 88 patients (70%) in the medical treatment group. A detailed list of serious adverse events is provided in the appendix (pp 35–38).
The results of subgroup analyses were generally supportive of the primary analysis (appendix p 21, 30), although the trial was not powered for subgroup analyses.
Figure 3: Kaplan-Meier analysis for mortality at 90 days
Analysis of mortality at 90 days was done in the safety population, including 128 patients who had received endovascular thrombectomy and 125 patients who had received medical treatment alone. HR=hazard ratio.
The perprotocol analysis included 97 patients in the endovascular thrombectomy group and 89 patients in the medical treatment group, and results were consistent with those of the primary intentiontotreat analysis
Endovascular thrombectomy (N=128) Medical treatment (N=125) Treatment effect (95% CI) p value Death or dependency (modified Rankin Scale 4–6) at 90 (±14) days (%), n/N 88/127 (69%) 103/119 (87%) 0·34 (0·18–0·65) 0·0011 Mortality (censored at 90 days; %), n/N 49/122 (40%) 63/123 (51%) 0·67 (0·46–0·98) 0·038 Mortality at 7 days or discharge 30 (23%) 36 (29%) 0·75 (0·42–1·32) 0·31 Stroke-related death (%), n/N 33/127 (26%) 36/119 (30%) 0·80 (0·46–1·41) 0·44 New ischaemic stroke 17 (13%) 20 (16%) 0·80 (0·39–1·60) 0·52 Space-occupying infarction 21 (16%) 17 (14%) 1·26 (0·63–2·54) 0·52 Parenchymal haemorrhage type 2 (%), n/N* 11/124 (9%) 10/116 (9%) ·· 0·95 Symptomatic intracranial haemorrhage† 7 (5%) 6 (5%) ·· 1·00 Fatal symptomatic intracranial haemorrhage 3 (2%) 4 (3%) ·· 0·72 At least one serious adverse event 71 (55%) 88 (70%) ·· 0·014 (appendix p 18, 27). The sensitivity analyses (bestcase scenario and worstcase scenario) were also consistent with the primary outcome analysis (appendix pp 17–18, 26–27). Given the imbalance in baseline ASPECTS among and between groups, we did an exploratory (not prespecified) analysis of the primary endpoint in the intentiontotreat population, adjusting for baseline ASPECTS, which was also consistent with the primary outcome analysis (appendix pp 28–29).
Data are n (%) unless specified. The treatment effect is reported for death (censored at 90 days), as an adjusted hazard ratio (95% CI). Other outcomes were reported as the adjusted OR (95% CI) or as Fisher’s exact test for small numbers. NIHSS=National Institutes of Health Stroke Scale. *Parenchymal haemorrhage type 2 was defined as an intracranial haemorrhage that involved more than 30% of the infarcted area with a substantial space-occupying effect or that was remote from the original infarcted area.
†Symptomatic intracranial haemorrhage was defined as an increase in the NIHSS score of ≥4 points or an increase in the score for an NIHSS subcategory of ≥2 points with presence of parenchymal haemorrhage type 2.
Table 3: Safety outcomes (safety population)
Discussion
The TENSION trial conducted in Europe and Canada showed that endovascular thrombectomy in addition to medical treatment resulted in improved functional outcome and lower mortality compared with medical treatment alone in patients presenting with a large brain infarction due to large vessel occlusion of the anterior brain circulation. Importantly, presence of a large infarction was identified by visual assessment of the infarct size mostly on unenhanced CT images without applying advanced imaging techniques or post processing tools. The trial was stopped early for efficacy after the preplanned first interim analysis of 222 patients. The primary outcome analysis showed a significant shift towards an improved functional outcome across the entire range of the mRS at 90 days in patients assigned to endovascular thrombectomy. Results of secondary outcomes, including proportions of patients with functionally independent outcome (modified Rankin Scale 0–2) and being able to walk unaided (mRS 0–3) at 90 days, were higher in the group assigned to endovascular thrombectomy. Additionally, mortality was lower in patients receiving endovascular thrombectomy than in those receiving medical treatment alone. No safety concerns emerged, and there was no increase in the rates of severe
or symptomatic intracranial haemorrhages with endovascular thrombectomy.
The benefit of endovascular thrombectomy in the patient population with large infarcts has been demonstrated in three recent studies.11–13 Patient selection in these trials was based either on predominantly MRI as a more sensitive method to determine the infarct size11 or on perfusion imaging and a dedicated postprocessing software12,13 to quantify core volume for patient inclusion. However, the most common standard in clinical practice worldwide used to assign patients to endovascular treatment is unenhanced CT supplemented by CTA to demonstrate the site of vessel occlusion.15,16 The TENSION trial aimed to use the clinical standard imaging for patient management by exclusively relying on visual image assessment of infarct size on either plain CT or MRI depending on local standards. Our results using this simple diagnostic algorithm yielded a comparable benefit of endovascular thrombectomy to previous trials,20 and, for the first time, also demonstrated a significant benefit in survival with endovascular thrombectomy. However, the benefit in survival with endovascular thrombectomy should be interpreted with caution as the trial was not powered to assess this and was stopped prematurely; therefore, the risk of a type I error was inflated. As in the previous trials, the overall rates of independent functional outcome were low and mortality was high across both groups in this population of patients with severe strokes. Nevertheless, endovascular thrombectomy in addition to medical treatment resulted in an absolute increase of 18% in the proportion of patients being able to walk independently at 90 days and an absolute decrease of 11% in mortality at 90 days.
The results of sensitivity analyses and the analysis of subgroups support these findings. The trial was not powered for subgroup analyses, but effect estimates were
in favour of endovascular thrombectomy in almost all prespecified subgroups. Endovascular thrombectomy was associated with a high recanalisation rate of 83% (mTICI 2b/3), which is in the usual range of recanalisation rates observed in previous trials of thrombectomy for stroke.21 We observed no significant effect of endovascular thrombectomy on the infarct size quantified 24 h after the procedure. A similar finding (ie, a benefit in functional outcome together with the absence of an effect on infarct size at 24 h) has also been reported in previous trials of endovascular thrombectomy22 and intravenous thrombolysis.23 Other surrogates of outcome (eg, reduction of rates of decompressive hemicraniectomy and of symptomatic intracranial haemorrhage) did not differ between groups, possibly due to the relatively small sample size.
Concerning safety, lower rates of severe adverse events were reported in patients receiving endovascular thrombectomy than in patients who received medical treatment alone. Overall, 7% of patients in the endovascular thrombectomy group had at least one serious adverse event related to the thrombectomy procedure, and there was no procedurerelated mortality. Most importantly, neither rates of radiologically defined large parenchymal haemorrhages nor symptomatic intracranial haemorrhages were increased with endovascular thrombectomy.
Our trial supports the results of the previous trials of endovascular thrombectomy in patients with stroke and large core and extends these findings in some important aspects. TENSION was based mainly on patients in stroke centres in Europe, who were underrepresented in previous studies conducted mainly in Asia or the USA. TENSION also demonstrates a clinically relevant reduction of patients with severe disability or death in patients with large vessel occlusion and already extended infarcts. This reduction by endovascular thrombectomy represents important additional information to support treatment decisions in this patient population in clinical practice. In our trial, the rate of functional independence (mRS 0–2) at 90 days in the medical group was lower than in previous trials (2% vs 7–11%).11–13 The severity of symptoms in TENSION, assessed by the NIHSS at baseline, was similar to previous trials. However, patients in TENSION were mostly included based on noncontrast CT, whereas, in other studies, methods more sensitive to the extent of the acute ischaemic lesion were used, such as perfusion CT or DWI. Thus, the real size of the ischaemic lesion at baseline might have been larger in TENSION than in other trials, resulting in a lower rate of good clinical outcome.
Finally, regarding the translation of our findings to clinical practice, it is reassuring that a pragmatic approach to imaging evaluation based mainly on visual assessment of infarct size on noncontrast CT yielded a similar clinical benefit to the more sophisticated, but also more complicated and timeconsuming, approaches involving MRI or perfusion imaging used in the previous
studies. We also observed a nonsignificant beneficial effect of endovascular thrombectomy in the subgroup analysis of patients with an ASPECTS value of 0–2 on posthoc core lab analysis. Comparable effects have also been reported in previous studies.12,13 Future trials and metaanalyses should define the lower boundary of ASPECTS value for a clinical benefit of endovascular thrombectomy.
Our trial has limitations. First, as the trial was stopped early for efficacy, the overall patient number was smaller than planned and, therefore, the analysis of subgroups is limited. Moreover, halted trials are more prone to exaggerated effects due to reduced sample size.24 Second, interrater agreement of early ischaemic signs on CT was only moderate; therefore, patient inclusion based on visual assessment of ASPECTS on CT or MRI only without further functional imaging or postprocessing might result in some variability. This was reflected by the results of the image core lab evaluation, which considered the ASPECTS values of 50 patients who were included in the study to be out of range for inclusion. However, this factor did not affect the overall clinical benefit of endovascular thrombectomy and the estimated treatment effect in the perprotocol population was not higher than in the intentiontotreat analysis. Enrolment in the trial was limited to patients in whom treatment could be accomplished within 12 h of symptom onset or last seen well, and to patients with an NIHSS of less than 26. We thus cannot generalise our findings to patients treated in a later time window or to those with more severe stroke symptoms. We also did not obtain data on race and ethnicity.
In this prospective randomised trial conducted in Europe and Canada, endovascular thrombectomy together with medical treatment was associated with improved functional outcomes and survival in patients with large vessel occlusions of the anterior circulation presenting with a large infarct on standard imaging compared with medical treatment alone, with no safety concerns.
Contributors
MB, JF, SB, AHA, BF, ERG, MDH, AK, LP, CZS, KZ and GT developed
the study protocol. MB, FS, and GT interpreted the data and drafted the manuscript. FS and AD analysed the data. All authors collected data and edited the manuscript. MB, FS, and GT accessed and verified the underlying data and all authors had access to the data and accept responsibility for submitting the article for publication.
Declaration of interests
MB reports funding from EU Horizon 2020 and Deutsche Forschungsgemeinschaft (payments to the institution); honoraria for lectures from Novartis, Boehringer Ingelheim, and Seagen; and consulting fees from NeuroScios and Boehringer Ingelheim and is an editor in chief of Clinical Neuroradiology (Springer). JF reports funding from the European Commission; personal consulting fees from Acandis, Cerenovus, Medtronic, Microvention, Phenox, Stryker, and Roche; consulting at Philips (no payments); payment or honoraria for lectures, presentations, speakers bureaus, manuscript writing or educational events from Penumbra and Tonbridge; support for attending meetings or travel from Medtronic and Penumbra; stock or stock options from Tegus Medical, Eppdata, and Vastrax; and participation in a Data Safety Monitoring Board or Advisory Board at Phenox (personal fees) and Stryker
(personal fees) and is a past president of ESMINT. SB reports funding from the EU Horizon 2020 research and innovation programme (754640; payments made to the institution); and support for attending meetings or travel from Medtronic and Penumbra; AHA reports unrestricted research grants from Boehringer Ingelheim; honoraria for lectures from BMS/ Pfizer, Teva, Roche, Abbvie, Lundbeck, and Novartis; and participation in Advisory Boards for MSD, BMS/Pfizer, Lundbeck, Lilly, and Abbvie.
BF reports research grants from Carlos III Institute of Health; personal payment for educational lectures from Servicio Madrileño de Salud; payment for lectures from Euromedice to the institution; personal payment for educational lectures from Takeda; support for attending meetings from Daiichi Sankyo; receipt of materials for research from Abbot. MDH reports funding from Nil; grants to the University of Calgary for the TEMPO2 trial from Boehringer Ingelheim, Biogen, NoNO (ESCAPENA1 trial and ESCAPENEXT trial), Canadian Institute for Health Research (ESCAPENA1 trial and ESCAPENEXT trial), Medtronic (HERMES collaboration), Alberta Innovates (QuICR Alberta Stroke Program); that some of the funds were used for the ESCAPENA1 trial from Alberta Innovates; consulting fees from Sun Pharma Brainsgate (paid work for adjudication of clinical trial outcomes);
US patents 62/086,077 (licensed to Circle NVI) and 10,916,346 (licensed to Circle NVI); private stock ownership from Circle and PUreWeb; participation as data and safety monitoring committee chair of the RACECAT trial (end 2020), the Oncovir Hiltonel trial (ongoing), and the DUMAS trial (ongoing); participation as a data and safety monitoring committee member of the ARTESIA trial (ongoing), and the BRAINAF trial (ongoing); and is president of the Canadian Neurological Sciences Federation (not for profit) and a Board member of the Canadian Stroke Consortium (not for profit). AK reports grants from the European Commission for the TENSION study (payment to the institution).
LP reports consulting fees from Balt, Microvention, and Phenox; and support for attending meetings or travel for the TENSION investigator meeting (transport and accommodation was reimbursed by the organization). CZS reports grants from Novo Nordisk Foundation and Health Research Foundation of Central Denmark Region. RAB reports speakers fees from Novo Nordisk and Beyer. HD reports financial compensation for the startup fee and the obligatory payment to the hospital administration paid by the sponsor (Medical University Heidelberg) to the clinical division (no personal payments); personal consulting fees from Stryker; speakers honorary from Medtronic; support for attending meetings or travel from Medtronic; and past presidency of the Austrian Society of Interventional Radiology and past presidency Austrian Society of Neuroradiology. FD reports consulting fees from Cerenovus, Phenox, Balt, Cerus Endovascular, Stryker; payment for expert testimony from Cerenovus; payment or honoraria for lectures, presentations, speakers bureaus, manuscript writing, or educational events from Cerenovus, Stryker, Acandis, Asahi, and Penumbra; participation in a Data Safety Monitoring Board or Advisory Board at Cerenovus; and previously work as an associate editor for Journal of NeuroInterventional Surgery and Journal of Clinical Medicine. FF reports consulting fees from Eppdata and support for attending meetings or travel from Microvention, Medtronic, Cerebrovascular Research and Education Foundation (CREF), and Acandis. SG reports consulting fees from Eppdata. CH reports consulting fees from Brainomix and lecture fees from Stryker.
SHJ reports funding for data collection, payment, or honoraria for lectures, presentations, speakers’ bureaus, manuscript writing, or educational events from Terumo. MG reports research grants from Medtronic and Cerenovus (payments to the University of Calgary); royalties or licenses from Microvention (systems of intracranial access); personal consulting fees from Microvention, Medtronic, Stryker, Mentice, Philips, and Penumbra; and stock or stock options from Circle Neurovascular. CFK was chair of the German stroke registry (unpaid).
RM reports payments for a stroke lecture from TMC Academy.
MM reports grants from Balt, Medtronic, MicroVention, and Stryker; consulting fees from Siemens; and support for attending meetings or travel from Europa Group. SMH reports consulting fees from Terumo and Boston Scientific Corporation; payment or honoraria for lectures, presentations, speakers’ bureaus, manuscript writing, or educational events from Terumo and Boston Scientific Corporation. NM reports the provision of study materials. PP reports support for attending meetings or travel for the TENSION investigator meeting (transport and
accommodation was reimbursed by the organisation). MP reports grants from the German Research Foundation (DFG SFB 1158 A10, DFG KFO 5001 P02, DFG KFO 5001 Z, and DFG SFB TR 240 B02); speaker
honoraria unrelated from Merck Serono and Bayer; and support for attending meetings or travel from Merck Serono (travel reimbursement) and Bayer (travel reimbursement). PAR reports consulting fees to the institution from Boehringer Ingelheim and Bayer; and payment or honoraria for lectures, presentations, speakers’ bureaus, manuscript writing, or educational events from Boehringer Ingelheim, Bayer, Pfizer, and BMS (all made to the institution). ES reports grants from Hamburg Innovation and Hertie Foundation. DFV reports research grants from MicroVention; consulting fees from Medtronic; and paid lectures from Cerenovus and Johnson & Johnson. WW reports consulting fees to the institution from Abbvie, BMS, GSK, and Servier. GT reports funding from the European Commission (EUHorizon 2020 research and innovation programme, 754640; payments to the institution); personal consulting fees from Acandis, AstraZeneca, Bayer, Boehringer Ingelheim, and Stryker; personal payment or honoraria for lectures, presentations, speakers bureaus, manuscript writing, or educational events from Acandis, Alexion, Marin, Bayer, Boehringer Ingelheim, BristolMyersSquibb/Pfizer, Daiichi Sankyo, and Stryker; participation as DSMB member for the TEA Stroke Trial (no payments) and ReSCInD trial (no payments); work as a speaker of the Commission for Cerebrovascular Diseases of the German Society of Neurology (DGN; no payments); and membership of the Board of Directors of the European Stroke Organisation (ESO; no payments). All other authors declare no competing interests.
Data sharing
Individual participant data that underlie the results reported in this article, after deidentification, will be made available on request beginning 12 months and ending 36 months following article publication to investigators whose proposed use of the data has been approved by the TENSION steering committee. Requests can be made by email to the corresponding author.
Acknowledgments
TENSION was supported by the EU Horizon 2020 research and innovation programme (754640). We thank the patients and their families for participating in the trial, the members of the data and safety monitoring board (Kennedy Lees [University of Glasgow],
Karl Wegscheider [Universitätsklinikum Hamburg–Eppendorf], and Phil White [Newcastle University]), the European Society of Minimally Invasive Neurological Therapy (ESMINT), the International Consortium for Health Outcomes Measurement (ICHOM), and the Stroke Alliance for Europe (SAFE) for their collaboration on the TENSION project.
References
- Berkhemer OA, Fransen PSS, Beumer D, et al. A randomized trial of intraarterial treatment for acute ischemic stroke. N Engl J Med 2015; 372: 11–20.
- Saver JL, Goyal M, Bonafe A, et al. Stentretriever thrombectomy after intravenous tPA vs tPA alone in stroke. N Engl J Med 2015; 372: 2285–95.
- Jovin TG, Chamorro A, Cobo E, et al. Thrombectomy within
8 hours after symptom onset in ischemic stroke. N Engl J Med 2015;
372: 2296–306.
- Goyal M, Demchuk AM, Menon BK, et al. Randomized assessment of rapid endovascular treatment of ischemic stroke. N Engl J Med 2015; 372: 1019–30.
- Campbell BCV, Mitchell PJ, Kleinig TJ, et al. Endovascular therapy for ischemic stroke with perfusionimaging selection. N Engl J Med 2015; 372: 1009–18.
- Nogueira RG, Jadhav AP, Haussen DC, et al. Thrombectomy 6 to 24 hours after stroke with a mismatch between deficit and infarct. N Engl J Med 2018; 378: 11–21.
- Albers GW, Marks MP, Kemp S, et al. Thrombectomy for stroke at 6 to 16 hours with selection by perfusion imaging. N Engl J Med 2018; 378: 708–18.
- Powers WJ, Rabinstein AA, Ackerson T, et al. Guidelines for the early management of patients with acute ischemic stroke:
2019 update to the 2018 guidelines for the early management of acute ischemic stroke: a guideline for healthcare professionals from the American Heart Association/American Stroke Association.
Stroke 2019; 50: e344–418.
- Turc G, Bhogal P, Fischer U, et al. European Stroke Organisation (ESO)–European Society for Minimally Invasive Neurological Therapy (ESMINT) guidelines on mechanical thrombectomy in acute ischemic stroke. J Neurointerv Surg 2023; 15: e8.
- Sarraj A, Hassan AE, Savitz S, et al. Outcomes of endovascular thrombectomy vs medical management alone in patients with large ischemic cores: a secondary analysis of the Optimizing Patient’s Selection for Endovascular Treatment in Acute Ischemic Stroke (SELECT) study. JAMA Neurol 2019; 76: 1147–56.
- Yoshimura S, Sakai N, Yamagami H, et al. Endovascular therapy for acute stroke with a large ischemic region. N Engl J Med 2022;
386: 1303–13.
- Sarraj A, Hassan AE, Abraham MG, et al. Trial of endovascular thrombectomy for large ischemic strokes. N Engl J Med 2023; 388: 1259–71.
- Huo X, Ma G, Tong X, et al. Trial of endovascular therapy for acute ischemic stroke with large infarct. N Engl J Med 2023; 388: 1272–83.
- Román LS, Menon BK, Blasco J, et al. Imaging features and safety and efficacy of endovascular stroke treatment: a metaanalysis of individual patientlevel data. Lancet Neurol 2018; 17: 895–904.
- Nogueira RG, Haussen DC, Liebeskind D, et al. Stroke imaging selection modality and endovascular therapy outcomes in the early and extended time windows. Stroke 2021; 52: 491–97.
- Kim Y, Lee S, Abdelkhaleq R, et al. Utilization and availability of advanced imaging in patients with acute ischemic stroke.
Circ Cardiovasc Qual Outcomes 2021; 14: e006989.
- Bendszus M, Bonekamp S, Berge E, et al. A randomized controlled trial to test efficacy and safety of thrombectomy in stroke with extended lesion and extended time window. Int J Stroke 2019;
14: 87–93.
- van Horn N, Kniep H, Broocks G, et al. ASPECTS interobserver agreement of 100 investigators from the TENSION study.
Clin Neuroradiol 2021; 31: 1093–100.
- von Kummer R, Broderick JP, Campbell BC, et al. The Heidelberg bleeding classification: classification of bleeding events after ischemic stroke and reperfusion therapy. Stroke 2015; 46: 2981–86.
- Goyal M, Demchuk AM, Hill MD. Endovascular therapy for ischemic stroke. N Engl J Med 2015; 372: 2366.
- Goyal M, Menon BK, van Zwam WH, et al. Endovascular thrombectomy after largevessel ischaemic stroke: a metaanalysis of individual patient data from five randomised trials. Lancet 2016; 387: 1723–31.
- Albers GW, Marks MP, Kemp S, et al. Thrombectomy for stroke at 6 to 16 hours with selection by perfusion imaging. N Engl J Med 2018; 378: 708–18.
- Thomalla G, Simonsen CZ, Boutitie F, et al. MRIguided thrombolysis for stroke with unknown time of onset. N Engl J Med 2018; 379: 611–22.
- Bassler D, Briel M, Montori VM, et al. Stopping randomized trials early for benefit and estimation of treatment effects: systematic review and metaregression analysis. JAMA 2010; 303: 1180–87.
-
Sepsis Update
A Year in Review Revised SSC Guidelines A Beacon of Light?

April 10, 2017
James D. Leo, MD, FACP, FCCP
Medical Director of Best Practice and Clinical Outcomes
Chair, Sepsis Best Practice Team MemorialCare Health System
Sepsis: What Happened in 2016?
- JAMA, Feb. 23, 2016: Sepsis-3, New criteria for defining sepsis

- Sepsis is redefined as : “life-threatening organ dysfunction caused by a dysregulated host response to infection.”
Sepsis: What Happened in 2016? Sepsis-3
- Organ Dysfunction: Rise in SOFA of ≥ 2 points


 Sepsis: What Happened in 2016? Sepsis-3
Sepsis: What Happened in 2016? Sepsis-3- Severe Sepsis: No longer used
- Sepsis:
- Suspected or documented infection and
 Acute increase of ≥2 SOFA points (a proxy for organ dysfunction)
Acute increase of ≥2 SOFA points (a proxy for organ dysfunction)
- Septic Shock:
- Sepsis and
- Vasopressor therapy needed to elevate MAP ≥65 mm Hg and
- Lactate >2 mmol/L (18 mg/dL) despite adequate fluid resuscitation
 Sepsis: What Happened in 2016? Sepsis-3
Sepsis: What Happened in 2016? Sepsis-3- qSOFA Score: A means of rapidly identifying ED and hospital ward (non- ICU) patients with suspected infection at increased risk




- At least 2 of 3 criteria:
- RR ≥ 22/min
- Altered mentation
- SBP ≤ 100 mmHg
 Sepsis: What Happened in 2016? Sepsis-3
Sepsis: What Happened in 2016? Sepsis-3The U.S. response to the new definition:

 Sepsis: What Happened in 2016? Sepsis-3
Sepsis: What Happened in 2016? Sepsis-3- U.S. professional societies didn’t adopt Sepsis-3 (ACEP, ACCP)


Chest May 2016
- CMS had already released SEP-1 Core Measure criteria based on Sepsis-2 definitions
 How Good is SOFA?
How Good is SOFA?JAMA 1/17/17


Conclusion: in the ICU, SOFA is better than SIRS or qSOFA

JAMA | Original Investigation | CARING F-OR THE CRITICALLY ILL PATIENT
Prognostic Accuracy of Sepsis-3 Criteria for In-Hospital Mortality Among Patients With Suspected Infection Presenting to the Emergency Department
Yonathan Freund, MD. PhD. Najla LemaÖiatti, MD. Evguenia Krastinova, MD, PhD: Marie Van Laer, MD. Yann-EnckClaessens, MD, PhD, Aurélie Avondo, MD; Céline Occelli, MD; Anne-Laure Ferai-Pierssens, MD;
Jennifer Tmchot. MD: Mar Drtega, MD. Bruno Carneiro, MD. Julie Pernet. MD: Rerre-Géraud Claret. MD. PhD;
Fabriœ Dami, MD. Ben Bloom, MD. Bmro Riou. MD, PhD: Sébastien Beaune. MD. PhD. farthe French Sooery of Ernergency Medicine Collaborators Group
Table Z. Diagnostic Performances forthe Pred’ætiori of In-Hospital Death
JAMA 1/17/17
For Prediction of Oeath qS0FA SDFA SIRS 
Sensitivi\y, % (95a CI) 70 (59-8d) 73 (61•82) 92 (85-98) 47(36 59} Specific ivy, % (95% CI) 79 (76-82) 70 (67 -72) 27 (24- J 1) 82(80-B5) Prcdictive value, (95% CI) Posit ise 24 (1 830) 18 (14-22) 11 (8- IJ) 20([4-27) h egat il e 97 (95-98) 97 /9s-98) 98 (95-99) 94(92-96) L ike ihood ratio (95s CI) Posit ise J.40 (2.80-4.17) 2.40 (2.00-2.90) 1.2 9 (1.17 – L. 3 7) 2.70 (2.00- 2.52) hegat ise 0.J7 (0.3 6-g.52) o.39 /o.›7-o.s6j d.25 (0.1 1 -0.58) 0.64 (g.51-0.79) AüROC. (9 5% CI) 0.80 (0.74-0.85) 0.7 7 (0.71-0.82) g.65 (0.59-0.70) o.6s /o.s9-o.7oj  How Good is qSOFA?
How Good is qSOFA?


- Retrospective review of ED and ward patients with suspected infection
- Compared SIRS, qSOFA, MEWS, and NEWS
- Primary endpoint: in-hospital mortality, and combined endpoint of mortality or ICU admission







 Select cutoNs to predict mortality or ICU transfer
Select cutoNs to predict mortality or ICU transferen ï i Specificity SIR5 z 2 q5OFA 2 2
9:t’¥• 

67%
NEWS L 7 7796 53& NSWS z 8 NEWS 2 9
67& 5A96
66% 78B
 How Good is qSOFA?
How Good is qSOFA?Conclusions:
- qSOFA has a poor sensitivity
- qSOFA is a late indicator of deterioration
- qSOFA is inferior to the NEWS score (despite the NEWS score being based on data which is equally easy to obtain at the bedside)

 Sepsis: What Happened in 2016? VANISH Trial
Sepsis: What Happened in 2016? VANISH Trial- Factorial 2 x 2 Design, DBRCT
Vasopressin + Placebo +/- Norepinephrine PRN
Norepinephrine + Placebo +/- Vasopressin PRN
Vasopressin + Hydrocortisone +/- Norepinephrine PRN
Norepinephrine + Hydrocortisone +/- Vasopressin PRN
Outcome: No difference in renal failure-free days.
No difference in mortality
 Statins in Sepsis
Statins in Sepsis
- Follow-up of patients from Statins for Acutely Injured Lungs from Sepsis (SAILS) Trial
- Compared rosuvastatin vs. placebo in patients with sepsis-induced ARDS
 Evaluated SF-36 physical function and mental health domains at 6 months
Evaluated SF-36 physical function and mental health domains at 6 months- Findings:
- No difference in 6-month survival
- No difference in physical function
- No difference in mental health
- No difference in 6-minute walk test
- “…survivors [demonstrated] substantial impairments in physical function and mental health.”
 Statins in Sepsis
Statins in Sepsis
- Another subgroup study from the SAILS Trial
 Evaluated impact of rosuvastatin on delirium
Evaluated impact of rosuvastatin on delirium- Findings:
- Most patients had delirium
– no between-group difference
-
- About 1/3 patients had cognitive impairment at 6 months
 Thiamine for Sepsis
Thiamine for Sepsis
- Thiamine 200 mg IV q12h vs. placebo x 7 days
- Endpoint: Lactate levels, time to shock reversal, SOI, mortality
- Findings:
- No difference in overall groups
- In patients with baseline thiamine deficiency (35% of total):
- Lower lactate
- Decreased mortality
 EGDT and AKI
EGDT and AKI
Am J Respir Crit Care Med 2/1/16
- Ancillary study to PROCESS Trial
- Evaluated impact of protocolized EGDT vs. standard care
- Finding: No difference in incidence/severity of AKI

 Out with the Old, In with the New
Out with the Old, In with the NewSurviving Sepsis Campaign 2016
Focusing on the changes from 2012
- Adopted Sepsis-3 definitions of sepsis and septic shock
- Sepsis: life-threatening organ dysfunction caused by a dysregulated host response to infection
- Septic shock: subset of sepsis with circulatory and cellular/metabolic dysfunction associated with a higher risk of mortality
- However, recognized that most of the studies forming the basis of guideline used traditional SIRS, sepsis, severe sepsis, septic shock
Surviving Sepsis Campaign 2016
- EGDT is gone as a specific recommendation
- Guide additional fluid by frequent reassessment of hemodynamic status
 If clinical examination dose not lead to clear diagnosis of volume status, use additional hemodynamic measures
If clinical examination dose not lead to clear diagnosis of volume status, use additional hemodynamic measures- Use dynamic rather than static variables to predict fluid responsiveness, where available
Surviving Sepsis Campaign 2016
-
- Optimize antimicrobial dosing based on accepted pharmacokinetic/ pharmacodynamics principles and particular drug properties in patients with sepsis/septic shock
- Increased incidence of renal and hepatic impairment
- Increased volume of distribution due to rapid expansion of ECV
- Initiate therapy with full, high-end loading dose to avoid frequent subtherapeutic levels
- Optimize antimicrobial dosing based on accepted pharmacokinetic/ pharmacodynamics principles and particular drug properties in patients with sepsis/septic shock



Surviving Sepsis Campaign 2016
-
- 7-10 days of antimicrobial therapy for most serious infections, but shorter duration for some (rapid clinical resolution after intra- abdominal source control, urinary sepsis, uncomplicated pyelonephritis)
- Suggest use of procalcitonin to support shortening duration of antimicrobial therapy
Surviving Sepsis Campaign 2016
-

 Use prone positioning for ARDS with PaO2/FIO2 ratio < 150 (previously 100)
Use prone positioning for ARDS with PaO2/FIO2 ratio < 150 (previously 100)- No recommendation regarding use of Non-Invasive Ventilation (previously limited use based on risk/benefit assessment)
Surviving Sepsis Campaign 2016
Enteral feeding
-
- Use prokinetic agents for feeding intolerance
 Place post-pyloric feeding tubes for feeding intolerance or if high risk for aspiration
Place post-pyloric feeding tubes for feeding intolerance or if high risk for aspiration
 A Beacon of Light
A Beacon of Light
The Marik Protocol
 Marik Protocol
Marik Protocol
Paul Marik, MBBCh
Chief of Pulmonary and Critical Care Medicine

Anti-thrombotic
Antiproliferative Antiagregant Anti•angiogenesis F°ru rLIGa W r W/V¥ MGa poprotein
Hem‹› t» iy Fibrinoli i metabolism
NORMAL EHDOTHELIUM

P’ Preies
Antip erative Prd§Urties
A t” nt Anti-a ogenesis
L”









DYSFUNCTIONAL ENDOTHELIUM





Basement
 membrane
membrane

Tight i• nction
Endothelial
nucleus
Intercellular
cleft


vesicles
Red blood
cell in lumen
Fenestra-
tions (pores)
Endothelial
nucleus
Basement membrane
“
Intercellular
Tight junction End
cell
Endothelial

Pinocytotic vesicles
(a)
Tight junction
Incomplete *“”
basement
(c) membrane
Pericyte Endothelial
Red blood

cell in lumen
Large interrellutar cleft
Nucleus of
endothelial cell
 Marik Protocol
Marik Protocol-
- Vitamin C 1.5 g IV q6h
- Thiamine 200 mg IV q12h
- Hydrocortisone 50 mg IV q6h
- For 4 days, or until patient is discharged from the ICU
 Marik Protocol
Marik Protocol-
- Entry criteria
- Severe sepsis or septic shock
- Procalcitonin ≥ 2 ng/ml
- Exclusions:
- < 18 years old
- Pregnant
- Limitations of care
- Retrospective before-after clinical study
- 7 months, 47 patients in each group
- Entry criteria
 Marik Protocol
Marik Protocol-
- No differences between the two groups
- Study group mortality: 8.5%
- Control group mortality: 40.4%
- No deaths in the study group due to sepsis
- No patient in the study group developed progressive organ failure
- Mean time to vasopressor independence: 18 hours vs. 54 hours
 Marik Protocol: Mechanism?
Marik Protocol: Mechanism?Vitamin C
-
- Potent antioxidant/free radical scavenger
- Restores other cellular antioxidants
- Essential co-factor for iron and copper-containing enzymes
- Inhibits NF-κB activation

 Vitamin C and NF-κB
Vitamin C and NF-κB
 Marik Protocol: Mechanism?
Marik Protocol: Mechanism?Vitamin C
-
- Potent antioxidant/free radical scavenger
- Restores other cellular antioxidants
- Essential co-factor for iron and copper-containing enzymes
- Inhibits NF-κB activation
- Increases endothelial and epithelial tight junctions
- Preserves endothelial function and microcirculatory flow
- Catecholamine synthesis and vasopressor sensitivity
 Marik Protocol: Mechanism?
Marik Protocol: Mechanism? Vitamin C is required for catecholamine synthesis
Vitamin C is required for catecholamine synthesis Why add Hydrocortisone?
Why add Hydrocortisone?- Vitamin C needs help getting into cells



6uany1yI
SVCT2


Ascorb«te
PKG
NfikB
 Marik Protocol: Mechanism?
Marik Protocol: Mechanism?- SVCT2
- Expression is down-regulated by pro- inflammatory cytokines
- Expression is up-regulated by corticosteroids
- Study of cultured endothelial cells + endotoxin
 Vitamin C alone: no help Steroids alone: no help
Vitamin C alone: no help Steroids alone: no helpVitamin C + steroids: Restored function
 Marik Protocol: Mechanism?
Marik Protocol: Mechanism?Why do we need extra vitamin C?
- Levels are very low or undetectable in critical illness
- Intestinal receptor is saturable, so can’t restore levels with oral dosing
Why does thiamine help?
 Shunts metabolism of vitamin C away from oxalate (potential for renal crystallization)
Shunts metabolism of vitamin C away from oxalate (potential for renal crystallization)
 Marik Protocol: Application
Marik Protocol: ApplicationWhat are the ethics of implementing this protocol?
“Hardcore evidence-based medicine disciples may be aghast at using a therapy without a large multi-center RCT, whereas more integrative, theoretically-minded clinicians may be willing to consider it.”
— Josh Farkas, MD
 Bioethical Principles
Bioethical Principles-
- Non-maleficence (“First, do no harm”)
- Harms of commission
 Harms of omission
Harms of omission
- Beneficence
- Autonomy
- Justice
- Non-maleficence (“First, do no harm”)
-
- Vitamin C: Oxaluria with potential for renal deposition and crystallization in patients with impaired renal function – but renal function improved more in the protocol group than in controls, and thiamine shunts vitamin C metabolism away from oxalate to CO2 production
- Thiamine: Rare reports of hypersensitivity or anaphylaxis, especially with repeated injections
Steroids in Severe Sepsis (HYPRESS Trial)
Steroids in Septic Shock:
CORTICUS Trial
(statistical significance not assessed)
- Hyperglycemia (≥ 150 mg/dl)
– ARI = 9.4%
– NNTH 10.6 (p=0.009)
– No statistically sig. difference in total insulin administered
- Secondary Infections
– ARI = 4.6%
– NNTH 21.7 (NS)
- Hyperglycemia (≥ 150 mg/dl)
– ARI = 13%
-
- NNTH 7.7
- Superinfection
- ARI = 5%
- NNTH 20
- New Septic Shock
- ARI = 4%
- NNTH 25
ARI = Absolute Risk Increase
-
- Annane – Effect of Treatment with Low Doses of Hydrocortisone and Fludrocortisone on Mortality in Septic Shock (JAMA 2002)
- Secondary Infection
- ARR 1% (NNTB 100)
- Vasopressor-associated harm
- ARI 2% (NNTH 50)
- Hyperglycemia – not reported
- Secondary Infection
- NB: All 3 studies, plus VANISH Trial, showed no mortality increase with steroids
- Annane – Effect of Treatment with Low Doses of Hydrocortisone and Fludrocortisone on Mortality in Septic Shock (JAMA 2002)
 Costs
Costs-
- IV Vitamin C: $88 – 260 for 4-day course (drug only)
- IV Thiamine: $45 for 4-day course (drug only)
- Hydrocortisone: ~ $80 (drug only)
 Implementation Options: A Proposal
Implementation Options: A ProposalPatients with Refractory Septic Shock
Severe Sepsis and Non- Refractory Septic Shock
- Already receiving steroids
- No/minimal predicted harm from adding Vitamin C and thiamine
- Reasonable to endorse use in this group
- These patients would not otherwise receive steroids per SSC Guidelines
- Inadequate Evidence- Based literature to justify endorsement
- Therefore, leave to individual practitioners to choose
 Some bad news…
Some bad news…- IV Vitamin C has a single producer:


Still…

 Sepsis Update 2017
Sepsis Update 2017Jim Leo, MD [email protected]
-

CHẨN ĐOÁN VÀ ĐIỀU TRỊ BỆNH ĐẠI TRÀNG THƯỜNG GẶP
ĐIỀU TRỊ
Bệnh lý đại tràng thường gặp
Clostridium difficile
- Trình bày điều trị Viêm túi thừa đại tràng
- Trình bày điều trị Hội chứng ruột kích thích
- Điều trị Viêm loét đại tràng
- Điều trị Viêm đại tràng do a-míp
- Điều trị Viêm đại tràng do Clostridium difficile
- Điều trị Viêm túi thừa đại tràng
- Điều trị Hội chứng ruột kích thích
IBD: Inflammatory Bowel Diseases
-
- Ulcerative Colitis (UC)
- Viêm loét đại tràng (VLĐT)
- Viêm trực tràng – đại tràng xuất huyết
- Crohn’s Disease
- Bệnh viêm ruột từng vùng
- Ulcerative Colitis (UC)
Historical timelines of Crohn’s disease & Ulcerative colitis throughout the world

The incidence of IBD rises in newly
industrialized countries
IBD is a disease of Westernized nations with rising incidence
IBD recognized throughout North America & Europe
Over 300 patients with ulcerative colitis
hospitalized in London
IBD is a global disease with increasing disease still rising
Incidence of ulcerative colitis stabilizes, Crohn’s Disease still rising
Ulcerative colitis is more common than Crohn’s disease
Paper on regional ileitis published in JAMA by Crohn
Wilks introduces ulcerative colitis into the medical vernacular
The global prevalence of IBD in 2015

Prevalence
- Highest
- Intermediate
- Lowest
- Uncharted
Tỷ lệ mới mắc UC 1,2-20,3 ca/100.000 người/năm Tỷ lệ lưu hành UC 7,6-246 ca/100.000 người
6
- Viêm loét đại tràng (VLĐT)
−Viêm & loét mạn tính, liên tục ở niêm mạc trực tràng & đại tràng, không có u hạt trên sinh thiết
−Diễn tiến bệnh giảm & tái phát
−Triệu chứng thường xuất hiện từ từ
−Điều trị nhằm giảm triệu chứng – lui bệnh & kéo dài giai đoạn lui bệnh
−Không có trị liệu nội khoa nào chữa khỏi bệnh
−Tử vong thường do biến chứng
Nguyên nhân chính xác chưa rõ
- Di truyền có vai trò trong bệnh nguyên (12-15%)
- Những người thân quan hệ gần có nguy cơ cao
- Một số vị trí gen liên có quan với VLĐT, HLA-DR & gen tham gia biệt hóa tế bào T helper 1 & 17
- Miễn dịch: viêm mô dạng lympho
- Ức chế đáp ứng miễn dịch, sản xuất Glo miễn dịch
- Sản xuất quá nhiều chất trung gian tiền viêm
- Rối loạn điều hòa đáp ứng miễn dịch của mô lympho ruột với vi khuẩn hội sinh trong ruột
Tuổi
-
- Khởi phát lần đầu thường trước 30 tuổi
- Có thể xảy ra bất cứ tuổi nào, ít gặp ở trẻ em
- Một số người bệnh lần đầu khi trên 60 tuổi
Chủng tộc
-
- Chủng tộc nào cũng có thể mắc bệnh
- Người da trắng, Do Thái: nguy cơ cao bị bệnh
- Sử dụng Isotretinoin (điều trị bệnh trứng cá)
Yếu tố bảo vệ
-
- Yếu tố ‘bảo vệ’ / khói thuốc lá?
- Cắt ruột thừa lúc trẻ (<20 tuổi): yếu tố bảo vệ
- Nhiễm giun, H.pylori: yếu tố bảo vệ?
- Triệu chứng phụ thuộc mức độ nặng viêm & vị trí tổn thương. Hầu hết triệu chứng nhẹ, trung bình; triệu chứng nặng hơn ở người trẻ tuổi
- Triệu chứng thường gặp
- tiêu chảy thường có máu & nhầy mủ, tiêu đêm
- đau quặn bụng, đau hố chậu trái
- mắc đi tiêu, mất khả năng tống thoát phân
- sụt cân
- mệt
- sốt
- Diễn tiến bệnh: một số lui bệnh kéo dài
Stomatitis
Aphthous ulcers
Episcleritis
Uveitis
Nephrolithiasis Hydronephrosis
Fistulae Urinary tract infection
Liver: Steatosis
Gallstones
Sclerosing cholangitis 2-7%
Spondylitis 1-2%
Sacroilitis
4-5%
Erythema nodosum
Peripheral arthritis 13-23%
Pyoderma grangrenosum


Biểu hiện ngoài ruột
10%-30%
Phlebitis
 Nhiễm độc toàn thân
Nhiễm độc toàn thân- Đại tràng giãn ≥ 5,5 cm
- Yếu tố nguy cơ
- Hạ kali máu
- Hạ magne máu
- Thụt tháo ruột
- Thuốc kháng tiêu chảy
- Chẩn đoán sớm, điều trị chuyên sâu, phẫu thuật sớm
tỷ lệ bệnh, tỷ lệ tử vong
- Nguy cơ ung thư
- Tỷ lệ mới mắc ~ 2%
- Nguy cơ tích lũy 20%-30% tại thời điểm 30 năm
- Yếu tố nguy cơ ung thư
- Thời gian bệnh dài
- Phạm vi tổn thương rộng
- Khởi phát bệnh lúc trẻ (trước 15 tuổi)
- Viêm đường mật xơ hóa nguyên phát
- Tiền căn gia đình bị ung thư đại tràng
Biểu hiện lâm sàng
- Triệu chứng tại ruột
- Biểu hiện ngoài ruột
- Biến chứng
- Thiếu máu
Cận lâm sàng
- Nhiễm trùng
- C-reactive protein, VS (: bệnh hoạt động)
- pANCA, ASCA
- Phân: bạch cầu ±
- Cấy phân (đợt bùng phát)
- Nội soi đại tràng, sinh thiết
- X quang bụng KSS
- CT scan bụng chậu 14
- VLĐT: viêm niêm mạc liên tục
- Bệnh Crohn: tổn thương xen kẽ mô lành


Bệnh Crohn
Mucosal
layer
Lamina propria
- plasma cell
- lymphocyte
- eosinophil
- neutrophil


Paneth cell metaplasia

Vị trí tổn thương & độ nặng của bệnh tương quan với biểu hiện lâm sàng của VLĐT
Viêm trực tràng
Viêm toàn bộ đại tràng
Viêm
đại tràng trái

- Proctitis involves only rectum (A)
- Proctosigmoiditis involves the rectum & sigmoid colon (B)
- Distal colitis involves only the left side of the colon (C)
- Pancolitis involves the entire colon (D)
- Backwash ileitis involves the distal ileum
A B C D
Mayo Clinic Endoscopy Subscore

Độ nặng theo Truelove – Witts
NHẸ TRUNG BÌNH NẶNG Số lần đi tiêu < 4 lần/ngày ≥ 4 – < 6 ≥ 6 lần và Mạch < 90 lần/ph ≤ 90 lần/ph >90 hoặc Thân nhiệt < 37.5°C ≤ 37.8°C >37.8 hoặc Hemoglobin > 11.5 g/dL ≥ 10.5 g/dL <10.5 hoặc ESR < 20 mm/h ≤ 30 mm/h > 30 hoặc CRP bình thường ≤ 30 mg/L > 30 mg/L VLĐT tái phát
Tái phát: đợt bùng phát ở bệnh nhân VLĐT đang lui bệnh lâm sàng (lui bệnh tự phát hoặc do điều trị thuốc)
-
- Tái phát sớm <3 tháng sau khi lui bệnh
- Tái phát không thường xuyên (≤1 lần/năm)
- Tái phát thường xuyên (≥2 lần tái phát/năm)
- Bệnh liên tục (VLĐT có triệu chứng dai dẳng không có giai đoạn lui bệnh)
- Thuốc kháng viêm: 5ASA, corticosteroid
- Thuốc ức chế miễn dịch
- Kháng thể đơn dòng – chất sinh học
- Thuốc ức chế calcineurin
- Hướng dẫn điều trị nội
- Phẫu thuật
- Giám sát ung thư
- Thay đổi lối sống
Mục tiêu điều trị
Lui bệnh & duy trì lui bệnh nhằm cải thiện chất lượng cuộc sống, giảm nhu cầu sử dụng corticosteroid kéo dài & giảm đến mức tối thiểu nguy cơ ung thư
- Lui bệnh: hết triệu chứng, lành niêm mạc
Lâm sàng: số lần đi tiêu ≤ 3/ngày, không chảy máu & không có cảm giác mắc đi tiêu
Không cần nội soi để xác nhận lành niêm mạc
-
- Điều trị VLĐT: thuốc, phẫu thuật?
- Lựa chọn điều trị cho VLĐT xem xét
- mức độ hoạt động (nhẹ, trung bình, nặng)
- phạm vi tổn thương (viêm trực tràng, viêm đại tràng trái, viêm toàn bộ đại tràng)
- diễn tiến của bệnh trong thời gian theo dõi
- sở thích của bệnh nhân
- cân nhắc giữa lợi ích & nguy cơ
THUỐC KHÁNG VIÊM: first choice
5-Aminosalicylates (5-ASA)
Tuân thủ 5ASA: nền tảng để cải thiện kết cuộc
-
- Sulfasalazine: 5-ASA & sulfapyridine
Tác dụng phụ do sulfapyridine: nhức đầu, nôn, buồn nôn, đau bụng, sốt, độc tính trên gan…
-
- 5-ASA: mesalamine, balsalazide & olsalazine Tác dụng phụ trên thận & tụy (hiếm)
Pentasa, apriso: phụ thuộc pH Asacol: pH=7
Aminosalicylate: Tác động trên ruột
26
Thuốc Liều (g/day) Đại tràng xa Đại tràng gần Ruột non Sulfasalazine 2-6 ++ +++ – Olsalazine 1-3 ++ +++ – Balsalazide 6.75-13.5 +++ +++ – Mesalamine Pentasa
2-4 ++ ++ ++ Asacol 2.4-4.8 ++ +++ + Apriso 1.5 ++ ++ ++ Lialda 2.4-4.8 ++ ++ – Rowasa enema 4 +++ – – Suppository 2-4 + – – Corticosteroid
- VLĐT trung bình-nặng không đáp ứng điều trị khác
- Tác dụng phụ: sưng mặt, rậm lông mặt, đổ mồ hôi đêm, mất ngủ & hiếu động, tăng huyết áp, đái tháo đường, loãng xương, gãy xương, đục thủy tinh thể, tăng nhãn áp & dễ nhiễm trùng
- Không sử dụng corticosteroid kéo dài
- Prednisone
−40-60 mg/ngày (u) đến khi cải thiện triệu chứng
− 5-10 mg/tuần đến 20 mg/ngày, 2,5-5 mg/tuần
- Hydrocortisone 100 mg X 4 lần/ngày tiêm mạch
- Methylprednisolone 40-60 mg/ngày tiêm mạch
- Kháng trị steroid
- bệnh hoạt động mặc dù sử dụng prednisolone 0,75 mg/kg/ngày trong 4 tuần
- Lệ thuộc steroid
- không thể giảm liều steroid: duy trì liều prednisolone 10mg/ngày trong 3 tháng bắt đầu steroid
- tái phát trong vòng 3 tháng sau khi ngừng steroid
- Giảm viêm, bằng cách ức chế đáp ứng miễn dịch toàn thân, ức chế hoạt tính của tế bào T
- Phối hợp thuốc có thể tốt hơn đơn độc
- Có thể dùng phối hợp với corticosteroid
- Kháng trị steroid
- corticosteroid giúp lui bệnh
- thuốc ức chế miễn dịch duy trì lui bệnh
- Đáp ứng với thuốc chậm sau 1-2 tháng
- Đáp ứng tối ưu sau 4 tháng
- Azathioprine chống chuyển hóa có cấu trúc purin có thể ức chế tổng hợp DNA, RNA & protein
- Mercaptopurine ức chế sinh tổng hợp acid nucleic
ức chế mạnh đáp ứng miễn dịch ban đầu, ức chế chọn lọc miễn dịch thể dịch
Kháng trị thuốc ức chế miễn dịch
Bệnh hoạt động hoặc tái phát mặc dù điều trị thiopurine với liều thích hợp ít nhất 3 tháng
Anti-TNF-α
- Infliximab 5mg/kg truyền tĩnh mạch tuần 0, 2, 6
- Adalimumab 160mg tuần 0, 160mg tuần 2 TDD
- Certolizumab 400mg tuần 0, 2 & 4 tiêm dưới da nguy cơ ung thư: lymphoma & ung thư da
Kháng thể integrin α47
- Vedolizumab 300mg truyền tĩnh mạch tuần 0 & 2
- nguy cơ nhiễm trùng & ung thư thấp
- Cyclosporine
- Sản phẩm chuyển hóa của nấm
- Ức chế đặc hiệu các tế bào lympho
- Ức chế sản xuất & giải phóng các lymphokin
- Tacrolimus
- Ức chế miễn dịch dẫn xuất từ
- Cyclosporine
Streptomyces tsukabaensis
-
-
- Ức chế kích hoạt lypho bào T
-
VLĐT nhẹ-trung bình VLĐT trung bình-nặng
- 5-ASA
- uống
- tại chỗ: tọa dược, dạng thụt
Lui bệnh xảy ra trong vòng 2 tuần
- Corticosteroid
- uống / tiêm tĩnh mạch
- loại trừ nhiễm trùng trước khi điều trị
- 6-mercaptopurine, azathioprine
- Anti-TNF-α
- Vedolizumab
The Washington Manual of Medical Therapuetics, 2016; 35th ed, C.18C 33
VLĐT nặng, bùng phát
- Corticosteroid TM
- Methylprednisolone
- Không đáp ứng steroid (ngày 3 điều trị steroid)
- Cyclosporine
- Tacrolimus
- Điều chỉnh dịch & điện giải
- Kháng sinh phổ rộng
- Heparin trọng lượng phân tử thấp TDD
- Truyền máu duy trì Hb >8-10 g/dl
- Dinh dưỡng đường tĩnh mạch?
Overview of disease status & drug therapy
Distal UC Extensive UC Mild Rectal or oral 5-ASA Rectal corticosteroid Topical and oral 5-ASA Moderate Rectal or oral 5-ASA Rectal corticosteroid Oral corticosteroid Topical and oral 5-ASA AZA or 6-MP Anti-TNF
Severe Rectal or oral 5-ASA Oral or IV corticosteroid Rectal corticosteroid IV corticosteroid IV cyclosporine or IV infliximab Steroid resistant or dependent AZA or 6-MP or preferably anti-TNF or combination AZA/6-MP + anti-TNF
AZA or 6-MP or anti-TNF or preferably combination AZA/6-MP + anti-TNF
Vedolizumab is another alternative
in moderate/severe disease
Quiescent Oral or rectal 5-ASA Oral AZA or 6-MP Oral 5-ASA Oral AZA or 6-MP
PHẪU THUẬT

Chỉ định tuyệt đối
- Xuất huyết lượng nhiều
- Thủng
- Ung thư biểu mô

36
PHẪU THUẬT
- Chỉ định phẫu thuật cấp cứu
- Phình đại tràng nhiễm độc kháng trị
- Đợt bùng phát kháng trị điều trị nội
- Chảy máu đại tràng không kiểm soát
- Thủng đại tràng
- Chỉ định phẫu thuật lựa chọn
- Lệ thuộc steroid
- Loạn sản, ung thư biểu mô tế bào tuyến
- Bệnh kéo dài 7-10 năm
GIÁM SÁT UNG THƯ


Sau 8-10 năm, 1–2 lần/năm,
nội soi đại tràng kèm sinh thiết nhiều mảnh


Tùy thuộc vị trí tổn thương, tổn thương kèm
- 3117 bệnh nhân Thụy Điển theo dõi 1-60 năm
- Viêm trực tràng: không tăng nguy cơ tương đối
– Viêm đại tràng T, RR: 2,8 (CI 95%: 11,4 -18,9)
-
- Viêm toàn bộ đại tràng, RR: 14,8
Viêm đại tràng T & toàn bộ: nội soi giám sát Viêm trực tràng: không cần nội soi giám sát
- Viêm đại tràng T: sau chẩn đoán VLĐT 8-10 năm nội soi giám sát 1-2 năm/lần
- Kèm Viêm đường mật xơ hóa nguyên phát
nội soi giám sát mỗi 1-2 năm sau chẩn đoán VLĐT
- Thay đổi chế độ ăn & lối sống
- Giúp kiểm soát triệu chứng
- Kéo dài thời gian giữa các cơn bùng phát
- Không có bằng chứng thức ăn gây VLĐT
- Một số thức ăn có thể làm nặng thêm triệu chứng bệnh hoặc bệnh bùng phát
- Hướng dẫn theo dõi ăn uống
- Phát hiện thức ăn khiến bệnh bùng phát
- Stress làm triệu chứng xấu hơn hoặc bệnh bùng phát. Tập thể dục giúp giảm stress, bớt trầm cảm & chức năng ruột bình thường
- Hạn chế sản phẩm từ sữa vì có thể tiêu chảy, đau bụng, trung tiện do không dung nạp lactose
- Chế độ ăn ít chất béo. Tránh bơ, bơ thực vật, nước xốt kem & thức ăn chiên rán
- Hạn chế chất xơ: thức ăn nhiều chất xơ (rau quả tươi, ngũ cốc nguyên hạt) triệu chứng xấu hơn
- Dùng rau quả hấp, nướng, hầm
- Thức ăn cay, rượu bia, café: triệu chứng xấu hơn
Nhiều bữa nhỏ, Bổ sung vitamin, muối khoáng
- Probiotics có thể giúp duy trì lui bệnh
E.coli chủng Nissle 1917 (200mg/ngày)
VIÊM ĐẠI TRÀNG DO NHIỄM TRÙNG
- VĐT do a-míp (Entamoeba histolytica)
- VĐT do giả mạc (Clostridium difficile)
- VĐT do lao (Mycobacterium tuberculosis) điiều trị thuốc kháng lao
VIÊM ĐẠI TRÀNG DO A-MÍP
Entamoeba histolytica phá hủy niêm mạc
vết loét đại tràng: khoét rộng trong niêm mạc, lổ vào thường rất nhỏ
tổn thương trực tràng: mót rặn, tiết nhầy nhiều
43
- Khởi phát từ từ, triệu chứng xuất hiện trong 1-2 tuần: đau bụng, tiêu chảy/ máu, giảm cân hoặc biếng ăn, sốt (10-30%)
- Viêm đại tràng bùng phát (<0,5% trường hợp)
- tiêu chảy máu nặng, sốt
- đau khắp bụng dữ dội, viêm phúc mạc
- tỉ lệ tử vong cao >40%
- nhóm nguy cơ: dinh dưỡng kém, mang thai, sử dụng corticosteroid và tuổi rất trẻ (<2 tuổi)
- Phình đại tràng nhiễm độc hiếm, do dùng corticoid
- Bướu amibe hiếm gặp
- Phân: thể kén, thể tư dưỡng




- Huyết thanh chẩn đoán amibe
- kháng thể tồn tại nhiều năm
- Nội soi đại tràng
- mẫu nạo niêm mạc
- mẫu sinh thiết
- Mô học
- X quang đại tràng cản quang
- Emetin hydrochlorid
1 mg/kg/ngày TB/TDD X 5 ngày
- Dehydroemetin
1,5 mg/kg/ngày TB/TDD X 5 ngày
- Chloroquin chỉ có tác dụng ở gan
- Imidazole
- Imidazole
- Metronidazole
- hiệu quả cao (tỉ lệ lành bệnh 90%)
- tương đối dung nạp tốt
- 750 mg x 3 lần/ngày X 5-10 ngày
- tác dụng phụ: buồn nôn, nhức đầu lú lẫn, thất điều, mất ngủ, dị cảm, tâm thần, động kinh
- Metronidazole
- Imidazole
- Metronidazole
750 mg X 3 lần/ngày X 5-10 ngày
-
- Tinidazole 2 g/ngày X 3-5 ngày
- Secnidazole 2 g X 5-7 ngày
- Ornidazole
0,5 g X 2 lần/ngày X 5-10 ngày
-
- Nimorazole
1 g X 2 lần/ngày X 5-10 ngày
- Diloxanide furoat
500 mg X 3 lần/ngày X 10
- Iodoquinol
650 mg x 3 lần/ngày X 10 ngày
- Paromomycin
25-30 mg/kg/ngày X 7 ngày
- Tetracycline
500 mg X 3 lần/ngày X 5 ngày
VIÊM ĐẠI TRÀNG DO C. difficile
- Đặc trưng: tiêu chảy, đau bụng, sốt
- Tiêu chảy thường không có máu
- Đau bụng hầu như luôn luôn có
- đau bụng nghiêm trọng
- dấu hiệu phúc mạc (rebound tenderness)
- Kiệt sức, lừ đừ, tổng trạng chung kém
- Thử nghiệm: thiếu máu, tăng bạch cầu & albumin huyết thanh thấp
- Trường hợp nặng: toxic megacolon
- Đa số các trường hợp, sử dụng kháng sinh
rối loạn hệ vi khuẩn ruột bình thường
C. difficile sinh độc tố phát triển
- Thường do Clindamycin, Cephalosporins (cefazolin & cephalexin) và Amoxicillin
- 7-10 ngày sau dùng kháng sinh
có thể muộn sau dùng kháng sinh 6 tháng
- Có thể xảy ra sau 1 liều kháng sinh duy nhất
- Đái tháo đường
- Người lớn tuổi
- Mới vừa đại phẫu
- Sử dụng thuốc ức chế bơm proton
- Điều trị hen bằng khí dung
- Sử dụng thuốc kháng cholinergic
Chẩn đoán VĐT C. difficile


Testing for the presence of the C. difficile antigen


Testing for toxin production A PCR assay targeting the toxin genes
- Ngừng điều trị kháng sinh
- Bù dịch đường tĩnh mạch
- Điều chỉnh bất thường điện giải
- Tránh sử dụng các thuốc kháng tiêu chảy (bệnh kéo dài, triệu chứng xấu hơn)
- 25% bệnh nhân không cần điều trị thêm
- Tái phát xảy ra trong 10-20% bệnh nhân
- Tiêu chuẩn chẩn đoán
– Tiêu chảy kèm theo không có bất cứ triệu chứng nào trong tiêu chí bệnh nặng hoặc có biến chứng
- Điều trị
- Metronidazole 500 mg X 3 lần/ngày uống 10 ngày
- Nếu không cải thiện trong 5-7 ngày, cân nhắc đổi thuốc vancomycin với liều chuẩn (vancomycin 125 mg X 4 lần/ngày uống 10 ngày)
- Nếu không dung nạp metronidazole, vancomycin 125 mg X 4 lần/ngày uống 10 ngày
- Tiêu chuẩn chẩn đoán
Albumin huyết thanh <3 g/dL kèm 1 trong số các triệu chứng sau
−Bạch cầu máu ≥15000 /mm3
−Đề kháng thành bụng
-
- Điều trị
Vancomycin 125 mg X 4 lần/ngày uống 10 ngày
Điều trị
nhiễm C.difficile nặng, có biến chứng
- Tiêu chuẩn chẩn đoán có bất cứ triệu chứng nào sau đây do nhiễm Clostridium difficile
- Nhập khoa săn sóc đặc biệt vì nhiễm C. difficile
- Hạ huyết áp cần hoặc không cần thuốc vận mạch
– Sốt ≥38.5°C
-
- Chướng bụng rõ hoặc liệt ruột
- Thay đổi tri giác
- Bạch cầu ≥35000 /mm3 hoặc <2000 /mm3
- Lactate huyết thanh >2,2 mmol/L
- Suy cơ quan (thông khí cơ học, suy thận…)
Điều trị
nhiễm C.difficile nặng, có biến chứng
- Điều trị
- Vancomycin 500 mg X 4 lần/ngày uống và Metronidazole 500 mg/8 giờ đường tĩnh mạch và Vancomycin đường trực tràng (vancomycin 500 mg pha trong 500 ml dung dịch đẳng trương như thụt tháo) X 4 lần/ngày
- Hội chẩn ngoại khoa
- Tiêu chuẩn chẩn đoán
Nhiễm Clostridium difficile tái phát trong vòng 8 tuần sau khi hoàn tất điều trị
- Điều trị
- Lập lại phác đồ Metronidazole hoặc
- Vancomycin pulse regimen: 125 mg mỗi 2 ngày hoặc 500 mg mỗi 3 ngày trong 3 tuần
- Xem xét việc cấy vi sinh phân sau 3 đợt tái phát
- Không sử dụng Cholestyramine & các resin a-xít mật khác vì thuốc có thể ức chế tác động của kháng sinh
- Probiotic (Saccharomyces boulardii – nấm men bánh mì) có thể làm giảm tỷ lệ tái phát viêm đại tràng màng giả
- Cắt đại tràng, nếu kháng sinh không khống chế được nhiễm trùng

VIÊM TÚI THỪA ĐẠI TRÀNG
62
VIÊM TÚI THỪA ĐẠI TRÀNG
Tăng sinh vi khuẩn
thủng vi thể, viêm quanh đại tràng
10-25% người có túi thừa bị viêm túi thừa Trẻ tuổi: bệnh nặng hơn
- Biểu hiện lâm sàng
- đau sâu, dai dẳng ¼ bụng dưới T (thường gặp)
- mót rặn, thay đổi thói quen đi tiêu, chảy – bón
- đi tiểu thường xuyên, khó tiểu (do kích thích)
- nhiễm trùng tiểu thường xuyên, tiểu khí (dò)
- liệt ruột, chướng bụng, buồn nôn, nôn
- tắc ruột non & thủng
- Khám thực thể
- Sốt
- Khám bụng
- Cận lâm sàng
- Máu ẩn / phân:
- bạch cầu: 36%
- XQ bụng: , liệt ruột, tắc, thủng, áp-xe
- CT bụng: phương pháp chẩn đoán lựa chọn
- Khám thực thể
- Kháng sinh đường tĩnh mạch
- Gentamycin hoặc Tobramycin 1,5 mg/kg/ 8g &
- Metronidazole 500 mg/ 8 giờ hoặc
- Clindamycin 300-600 mg/ 6 giờ
- Thuốc thay thế Ticarcillin-clavulanic acid
- Để ruột nghỉ ngơi
- Không ăn uống qua đường miệng
- Nuôi ăn qua đường truyền tĩnh mạch
- Tắc ruột, liệt ruột hút dạ dày
- Điều trị ngoại trú trong trường hợp
- đau khu trú
- không viêm phúc mạc khu trú
- không nhiễm trùng toàn thân
- Điều trị ngoại trú trong trường hợp
- Để ruột nghỉ ngơi: ăn lỏng trong 48 giờ
- Kháng sinh phổ rộng uống
- Một trong các thuốc sau
- Ampicillin 500 mg mỗi 6 giờ
- Trimethoprim/Sulfamethoxazole 960 mg/12 giờ
- Ciprofloxacin 500 mg/ 12 giờ
- Cephalexin 500 mg/ 6 giờ
- Phối hợp
- Metronidazole 500 mg/ 6-8 giờ hoặc
- Clindamycin 300 mg/ 6 giờ
- Một trong các thuốc sau
Hội chứng ruột kích thích
69
- Leong SA, et al (2003) The economic consequences of irritable bowel syndrome: a US employer perspective. Arch Intern Med 163:929–935.
- Simrén M, et al (2006). Health-related quality of life in patients attending a gastroenterology outpatient clinic: functional disorders versus organic diseases. Clin Gastroenterol Hepatol. 4(2): 187–195.
- Hội chứng ruột kích thích (Irritable Bowel Syndrome – IBS)
Rối loạn tiêu hóa chức năng được đặc trưng bởi đau bụng và thay đổi thói quen đi tiêu, không có bệnh lý thực thể đặc thù ở đại tràng
- Giảm chất lượng cuộc sống đáng kể Chi phí y tế 1,2
70


Prevalence of Irritable Bowel Syndrome1
1 Enck et al. Nat Rev Dis Primers 2016. Data from 2 are supplemented by studies from another 9 countries
2 Lovell RM, et al. Clin Gastroenterol Hepatol. 2012; 10(7): 712–721.
<5%
5%-9%
10%-14%
15%-19%
20%-29%
>30%
Not applicable
Khoảng 11% dân số chung bị IBS2 40% IBS-D, 35% IBD-C, 23% IBD-M2
Tác động của IBS
71
Feelings of
nervousness
Lack of energy
Lack of satisfaction with sex life
Worry about IBS
worsening
Trouble meeting
family’s needs

irritablebowelsyndrome.net
Đau
Pain
Mệt mỏi
Feel ill
Hopelessness
Feelings of
sadness
Buồn bã
Chán nản
Lo lắng IBS ngày xấu hơn
Căng thẳng
Thiếu sức sống
The IBS In America 2018 online survey gathered insights from 1,584 individuals currently suffering from IBS to better understand their symptoms and management of this condition, as well as the impact on their lives.
Khó đáp ứng nhu cầu gia đình
Không hài lòng cuộc sống lứa đôi
Biến chứng của IBS

irritablebowelsyndrome.net
55% Hemorrhoids
47% GERD
20% Anal fissures
17% Malnutrition
14% Anemia
The IBS In America 2018 online survey gathered insights from 1,584 individuals currently suffering from IBS to better understand their symptoms and management of this condition, as well as the impact on their lives.
72
Căn nguyên và Bệnh sinh IBS
Weaver KR, e al. Irritable Bowel Syndrome. Am J Nurs. 2017 Jun;117(6):48-55
Những yếu tố sinh lý và tâm lý được đề xuất là yếu tố tiềm năng trong nguyên nhân và sinh bệnh của IBS:
-
- Rối loạn vận động đường tiêu hóa
- Viêm
- Quá mẫn nội tạng
- Thay đổi hệ vi sinh đường ruột
- Chế độ ăn
- Di truyền
- Stress (kể cả những biến cố đầu đời)
73
Gut–Brain Axis
74
Ford AC, et al. Irritable Bowel Syndrome. NEJM. 2017 Jun 29;376(26):2566-2578
Nhiễm trùng, viêm,
kháng nguyên thực phẩm & thuốc
Thay đổi vùng nối &
tính thấm ruột
Thay đổi hệ vi sinh đường ruột
Thay đổi chức năng hệ thần kinh trung ương
Xâm nhập tế bào viêm, thay đổi chức năng miễn dịch tế bào, phóng thích cytokine
Xuất hiện hoặc đợt cấp triệu chứng IBS
1978 1984 1989 1990 1999 2006 2016
Manning
Kruis
Rome
I
II
Rome III
≥2 of t
he followings
ension, relief in with bowel ement
ser & more ent bowel ements with nset of pain
sage of mucus nsation of mplete
uation

- Dist
of pa mov
- Loo
frequ mov the o
- Pas
A At least 3 m S symptoms o Ir Abdominal p S 1. Relieved
It 2. Associat
Diagnostic
core for the ritable Bowel yndrome
s Value in the xclusion of rganic
isease
heck list to he patient & he doctor months
onths of continuous or recurrent
f one of the followings:
ain or discomfort by defecation
ed with a change in frequency of stool ed with a change in stool consistency more of the following for at least one ccasions or days:
tool frequency
E 3. Associat O Plus Two or D quarter of o
– C 1. Altered s
At least 12 weeks, w be consecutive, in t months of abdomina pain that has two of t
- Relieved with def
hich need not
he preceding 12 l discomfort or hree features: ecation; and/or with a change ol; and/or
with a change
- Onset associated in frequency of sto
- Onset associated
in form of stool.
– A se t
inco t
evac 6
12 months
-
- Altered stool form
- Altered stool passage
- Passage of mucus
- Bloating or feeling of abdominal distention
75
Rome IV Criteria (2016) a
-
-
- Recurrent abdominal pain, on average, at least 1 day/week in the last 3 months, associated with two or more of the following criteria:
- Related to defecation
- Associated with a change in frequency of stool
- Associated with a change in
-
form (appearance) of stool
76
Rome IV Criteria a
- Đau bụng tái phát, ít nhất 1 ngày / tuần trong 3 tháng gần đây, kèm hai hoặc nhiều tiêu chí sau:
- Liên quan với đi tiêu
- Thay đổi số lần đi tiêu
- Thay đổi hình dạng phân
a Các tiêu chí được hoàn thành trong 3 tháng gần đây với triệu chứng khởi phát ít nhất 6 tháng trước khi chẩn đoán
a Criteria fulfilled for the last 3 months with symptom onset at least 6 months before diagnosis

Lewis SJ, Heaton KW (1997) Stool form scale as a useful guide to intestinal
transit time. Scandinavian Jorunal of Gastroenterology 32: 920–4
Identifying IBS Subtypes




Subtype Stool type 1 & 2 Stool type 6 & 7 IBS with predominant constipation More than 25% Less than 25% IBS with predominant diarrhea Less than 25% More than 25% IBS with mixed bowel habits
More than 25% More than 25% IBS Unclassified: Patient who meets diagnostic criteria for IBS but their bowel habits cannot be accurately categorized into one of the three subtypes above.
Phân loại IBS




Phân loại Tính chất phân loại 1,2 Tính chất phân loại 6,7 IBS bón >25% <25% IBS tiêu chảy <25% >25% IBS hỗn hợp >25% >25% IBS phân loại không xác định: đạt đủ tiêu chuẩn chẩn đoán IBS, nhưng thói quen đi tiêu không thể phân loại chính xác vào một trong ba phân nhóm trên

Drossman DA. Gastroenterology & Hepatology Volume 13, Issue 11 November 2017.
Biomarkers are not likely to replace the Rome criteria.
It remains to be seen how they would help make a more precise diagnosis, but it is understood that biomarkers would play a role in managing treatment.
80
Chẩn đoán Hội chứng ruột kích thích
Ford AC, et al. Irritable Bowel Syndrome. NEJM. 2017 Jun 29;376(26):2566-2578
Tiêu chuẩn IBS Rome IV và
Không có những dấu hiệu cảnh báo:
- Tuổi ≥50
- Thay đổi thói quen đi cầu mới đây
- Xuất huyết tiêu hóa (tiêu phân đen hoặc tiêu máu đỏ)
- Đau bụng ban đêm hoặc đi tiêu ban đêm
- Giảm cân không chủ ý
- Tiền căn gia đình bị K đại trực tràng hoặc bệnh ruột viêm
- U bụng hoặc hạch to
- Thiếu máu thiếu sắt
- Máu ẩn trong phân dương tính
81
Diagnostic Algorithm for the IBS
82
Ford AC, et al. Irritable Bowel Syndrome. NEJM. 2017 Jun 29;376(26):2566-2578

Người bệnh có triệu chứng đau bụng mạn liên quan táo bón hoặc tiêu chảy, có hoặc không có đầy hơi
Hỏi bệnh sử, khám thực thể (tiền căn nội, ngoại khoa, chế độ ăn uống và thăm trực tràng)
Nếu khám sức khỏe bình thường và không có dấu hiệu cảnh báo, áp dụng tiêu chí Rome IV
Chẩn đoán xác định IBS
Sử dụng phân loại phân Bristol để xác định thể IBS
Cân nhắc một số xét nghiệm (CTM, CRP, huyết thanh chẩn đoán celiac, định lượng calprotectin trong phân)
Bắt đầu điều trị dựa vào triệu chứng ưu thế
Điều trị IBS
Điều trị triệu chứng theo thể bệnh lâm sàng
-
- Điều trị triệu chứng đau bụng
Thay đổi lối sống, chế độ ăn
83
Điều trị triệu chứng Tiêu chảy trong IBS
Lacy BE, et al. Gastroenterology 2016;150:1393–1407
Liệu pháp Liều Opioid agonists Loperamide 2–4 mg; when necessary titrate up to 16 mg/d Bile salt sequestrants Cholestyramine (9 g bid–tid) Colestipol (2 g qd–bid) Colesevelam (625 mg qd–bid) Probiotics Multiple products available Kháng sinh Rifaximin 550 mg po tid X 14 d Chất đối vận 5-HT3 Alosetron (0.5–1 mg bid) Ondansetron (4–8 mg tid) Ramosetron 5 mg qd Mixed opioid agonists/antagonists Eluxadoline 100 mg bid Điều trị triệu chứng Táo bón trong IBS
Lacy BE, et al. Gastroenterology 2016;150:1393–1407
Liệu pháp Liều Psyllium up to 30 g/d in divided doses PEG (polyethylene glycols) 1 gói/ngày Hoạt hóa kênh Chloride Lubiprostone 8 g bid Đồng vận Guanylate Cyclase C Linaclotide 290 g qd Lacy BE, et al. Gastroenterology 2016;150:1393–1407
Điều trị triệu chứng Đau bụng trong IBS
Liệu pháp Liều Thuốc chống co thắt Dicylomine (10–20 mg, 1–4 lần/ngày Otilonium (40–80 mg, 2–3 lần/ngày) Mebeverine (135 mg, 3 lần/ngày) Tinh dầu bạc hà Tan ở ruột (250–750 mg, 2–3 lần/ngày) Thuốc chống trầm cảm 3 vòng Desipramine (25–100 mg), Amitriptyline (10– 50 mg) mỗi ngày trước ngủ tối
SSRIs (Các chất ức chế tái hấp thu serotonin có chọn lọc) Paroxetine (10–40 mg, 1 lần/ngày) Sertraline (25–100 mg, 1 lần/ngày) Citalopram (10–40 mg, 1 lần/ngày) Hoạt hóa kênh Chloride Lubiprostone (8 g, 2 lần/ngày) Đồng vận Guanulate Cyclase C Linaclotide (290 g, 1 lần/ngày) Chất đối vận 5HT3 Alosetron (0,5–1 mg, 3 lần/ngày) Thuốc chống co thắt trong điều trị IBS
87
Song KH, et al. Clinical Practice Guidelines for Irritable Bowel Syndrome in Korea, 2017 Revised Edition.
Journal of Neurogastroenterology and Motility. 2018;24:197-215
Thuốc Liều bắt đầu Liều tối đa Chẹn kênh Ca Alverine citrate 60-180 mg/ngày 360 mg/ngày Mebeverine 300 mg/ngày 405 mg/ngày Otilonium bromide 60 mg/ngày 120 mg/ngày Pinaverium bromide 150 mg/ngày 300 mg/ngày Peppermint oil 0,6 ml/ngày Anticholinergic agent
Hyoscine 30 mg/ngày 60 mg/ngày Cimetropium 100 mg/ngày 150 mg/ngày Các thuốc khác Trimebutine 300 mg/ngày 600 mg/ngày Phloroglucinol 160 mg/ngày 88
Song KH, et al. Clinical Practice Guidelines for Irritable Bowel Syndrome in Korea, 2017 Revised Edition.
Journal of Neurogastroenterology and Motility. 2018;24:197-215
Thuốc chống co thắt trong điều trị IBS
Thuốc Tác dụng phụ Comment Alverine citrate Đau bụng, tiêu chảy, nôn, buồn nôn, nhức đầu Kết hợp với simethicone làm giảm đau bụng và khó chịu so với giả dược Mebeverine Mề đay, phù mạch, phản ứng phản vệ
Tốt hơn trong kiểm soát đau bụng so với giả dược
Otilonium bromide
Tăng áp lực nội nhãn Giảm tần số đau bụng, đầy hơi Cải thiện tần số đi tiêu & đánh giá chung so với giả dược Tái phát thấp hơn sau điều trị
Pinaverium Chướng bụng, đau bụng, tiêu chảy Tốt hơn trong cải thiện triệu chứng chung so với giả dược Peppermint oil Ợ nóng Tốt hơn trong kiểm soát đau bụng 
Hiệu quả giảm đau trong IBS
Forte E, et al. 2012
Meta-analysis of 21 studies on the effectiveness of antispasmodics in the treatment of IBS patients: Results expressed as percentage of patients with overall improvement
89
90

* Barmeyer C, et al. Long-term response to gluten-free diet as evidence for non-celieac wheat sensitivity in one third of patient with diarrhea-dominant and mixed-type IBS. Int J Colorectal Dis (2017) 32:29–39
** Lacy BE, et al. Bowel Disorders. Gastroenterology. 2016;150:1393-1407
Thay đổi lối sống, chế độ ăn
-
- Thay đổi lối sống có thể cải thiện triệu chứng IBS (tập luyện, giảm căng thẳng, chú ý đến giấc ngủ)
- Bổ sung chất xơ: nền tảng của điều trị IBS, việc sử dụng tối ưu tùy theo từng người
- Một số dạng chất xơ, đặc biệt là cám, có thể làm trầm trọng thêm chướng bụng, đầy hơi
- Chế độ ăn: No/low gluten *, Low FODMAP **
Kết luận
-
- Bệnh lý đại tràng đa dạng
- Thường diễn tiến mạn tính
- Cần quan tâm để phát hiện sớm, giúp cải thiện chất lượng cuộc sống và tiên lượng
Võ Thị Mỹ Dung
Bộ môn Nội tổng quát, ĐHYD TPHCM
91
-

CHẨN ĐOÁN VÀ ĐIỀU TRỊ VIÊM LOÉT DẠ DÀY TÁ TRÀNG
NỘI DUNG
-
- Đại cương
- Điều trị
- Nguyên tắc điều trị và phòng ngừa
K25.9: Loét dạ dày K26.9: Loét tá tràng
ĐẠI CƯƠNG
K27.9: Loét dạ dày-tá tràng K29.5: Viêm dạ dày
K29.8: Viêm tá tràng
K29.9: Viêm dạ dày-tá tràng
- LDD: phần đứng, thành sau, tiền môn vị
 LTT: loét HTT # 90% LTT, sau môn vị 1-3 cm thành trước, thành sau
LTT: loét HTT # 90% LTT, sau môn vị 1-3 cm thành trước, thành sau- 3-4 LTT / 1 LDD
- 4% LDD kèm LTT
- Tỉ lệ tử vong
do LDD/LTT ~1/100000
- Tỉ lệ tử vong do xuất huyết do LTT ~ 5%
- ~ 4,5 triệu người Mỹ bị LDD/LTT / năm
- Tỉ lệ mới bị LTT trong 3-4 thập niên qua
- Tỉ lệ LDD không có biến chứng
- Tỉ lệ LDD có biến chứng không đổi, nghi ngờ ác tính nếu loét dạ dày kéo dài
- Tỉ lệ bệnh trước đây ♂ >> ♀, hiện: ♂ # ♀
- Tỉ lệ bệnh suốt đời ♂ 11-14%, ♀ 8-11%
- Tỉ lệ nhiễm H. pylori suốt đời 20%
- Tỉ lệ tiệt trừ H. pylori thành công <80%
Tỷ lệ hiện nhiễm H.pylori trên thế giới


Hooi JKY. Global Prevalence of H.pylori Infection. Gastroenterology 2017;153:420–429
Hooi JKY, et al. Gastroenterology 2017;153:420–429 .
7
BỆNH SINH
PEPSINOGEN




MUCUS
YẾU TỐ PHÁ HỦY –YẾU TỐ BẢO VỆ
1910 Schwarz DK – No acid, no ulcer 1955 Davenport H, Code C, Scholer J
Gastric mucosal barrier
1970s Vane JR, Robert A, Jacobson E
PGs & gastric cytoprotection
1983 Warren R, Marshall B
The discovery of H. pylori in gastric mucosa 2005 Nobel Prize in Medicine
- Nhiễm trùng: Helicobacter pylori, herpes simplex virus, cytomegalovirus, Helicobacter heilmannii, nhiễm trùng hiếm gặp (tuberculosis, syphilis, mucormycosis,…)
- Thuốc (tất cả các thuốc có thể gây tổn thương niêm mạc khi dùng kèm NSAID hoặc ở người có nguy cơ cao): NSAID và aspirin, kể cả aspirin liều thấp, bisphosphonate, clopidogrel, corticosteroid, sirolimus, KCl, spironolactone, mycophenolate mofetil, hóa trị
2018 UpToDate
- Tăng tiết a-xít do nội tiết hoặc chất trung gian: bướu tiết gastrin (hội chứng Zollinger-Ellison), bệnh mastocytosis, bệnh tăng sinh tủy tăng bạch cầu ái kiềm, cường năng tế bào G hang vị
- Hậu phẫu: cắt hang vị, post-gastric bypass
- Suy mạch máu, do sử dụng cocaine
- Cơ học: nghẽn tắc tá tràng (tuyến tụy hình khuyên)
- Xạ trị
- Bệnh do thâm nhiễm: sarcoidosis, bệnh Crohn
2018 UpToDate
Căn nguyên và bệnh đi kèm

Loét dạ dày/tá tràng vô căn
-
- Loét dạ dày/tá tràng không nhiễm Helicobacter pylori, không sử dụng NSAID
Loét kèm bệnh mạn mất bù hoặc suy đa cơ quan cấp
-
- Loét do stress (bệnh nhân nằm ICU)
- Xơ gan
- Ghép tạng
- Suy thận
- Bệnh phổi tắc nghẽn mạn (do hút thuốc)
2018 UpToDate
ĐIỀU TRỊ



Thuốc giảm tác động của yếu tố phá hủy
Thuốc tăng khả năng bảo vệ niêm mạc dạ dày
EnteroChromaffin Like
č«tc›ic New0us 3ystem
(rčfay fr CNS or i t im ir )
FUNDUS
H, g G (CEK• B)
ANTRU/€








Early
sčomach
Late
(+UNQU5 & DY}
Enteric Nervous System (relay from CNS or intrinsic)
STD
G (CCK-B)
G (CYK-B}
ANTRUM
Somatostatin
Gastrin
SEPARATION !
OF-FUNDUS AND
Acid (destructive)
O H, antagonists (blockers) O Proton Pump Inhibitors
Anticholinergics O Sucralfate (luminal coating)
Early
stomach *
Late
‘ stomach !
STOPIACH LUMEN







(FUNDUS & BODY)
O Misoprostol (PG analog) Bismuth, Antibiotics ” O NSAIDs (CDX1 inhibition) O Octreotide (somat. analog)
proteins (-) feedback
THUỐC
Thuốc tác động của a-xít
TÁC ĐỘNG CỦA QUÁ TRÌNH PHÁ HỦY
ANTACID KHÔNG HÒA TAN

-
- Antacid không hòa tan trung hòa acid
Anti H2 ức chế thụ thể Histamin H2
-
- Thuốc ức chế bơm Proton
Thuốc ức chế thụ thể choline
- Thuốc bảo vệ niêm mạc
- Điều trị phối hợp
- Điều trị tiệt trừ H. pylori
THUỐC
GIẢM TÁC ĐỘNG CỦA A-XÍT
- Antacid không hòa tan
- Kháng thụ thể histamine 2
- Ức chế bơm proton
- Ức chế thụ thể cholin
-
- Aluminum hydroxide – Al(OH)3 Alternagel, Amphojel, Alu-tab
- Aluminum phosphate
-
Gasterin gel, Phosphalugel, Stafos
-
-
- Magnesium hydroxide: Mag-Ox 400
- Phối hợp Al(OH)3 & Mg(OH)2 Maalox
-
Gamaxcin, Varogel, Gelusil, Mylanta
- Tác động dược học
- Trung hòa a-xít dạ dày
- pH dạ dày, hành tá tràng
- ức chế phân giải protein của pepsin
- không tráng niêm mạc
- trương lực cơ vòng thực quản dưới
- Ion Al ức chế sự co cơ trơn
- Trung hòa a-xít dạ dày
ức chế làm trống dạ dày
ANTACID: TÁC DỤNG PHỤ

- Antacid Mg
- Tiêu chảy
- Mg máu / suy thận
- Antacid Al
- Bón
- Tích tụ Al máu, xương, TKTƯ
- Loãng xương, phosphate máu
- a-xit phản ứng ngược phụ thuộc liều
- Hội chứng sữa – kiềm
ANTI H2
ức chế thụ thể Histamin H2

- 1960: Cimetidine 800-1200 mg/ ngày
- 1981: Ranitidine 150-300 mg/ ngày
- 1981: Famotidine 20-40 mg/ ngày
- 1987: Nizatidine 150-300 mg/ ngày
- Tác động dược học
- ức chế histamine tại thụ thể H2 cạnh tranh thuận nghịch
- ức chế tiết dịch lúc đói & ban đêm
- ức chế tiết dịch do thức ăn, insulin, cà phê, pentagastrine, betazole
- Chống chỉ định
- tăng nhạy cảm
- Nồng độ đạt tối đa trong máu sau uống 1-3 giờ
- Cimetidine ức chế các enzyme P450 CYP1A2, CYP2C9, CYP2C19, CYP2D6, CYP2E1, CYP3A4
- Ranitidine ức chế CYP ít hơn cimetidine
- Famotidine tác động không đáng kể trên CYP
- Nizatidine >90% được bài tiết qua nước tiểu trong vòng 12 giờ; # 60% ở dạng không đổi
Chức năng thận giảm: Điều chỉnh liều anti histamin H2
-
- Tác dụng phụ
- nhức đầu, chóng mặt, lẫn lộn
- buồn ngủ, mất ngủ, ảo giác
- buồn nôn, nôn, tiêu chảy, bón
- tiểu cầu, rụng tóc, ban, đau khớp
- nữ hóa vú, bất lực, giảm khoái cảm
- Tác dụng phụ
THUỐC ỨC CHẾ BƠM PROTON

Men H+,K+ ATPase – 1970s
- Bơm proton trong tế bào thành
- Cấu trúc bơm proton gồm
- Chuỗi alpha: 1034 amino acid là các cysteine đóng vai trò chính trong hoạt động men
- Chuỗi beta: 291 amino acid
PPI tác động lên cysteine 813
THUỐC ỨC CHẾ BƠM PROTON
Benzimidazoles
1989: Omeprazole 20-40 mg/ ngày 3
1991: Lansoprazole 15-30 mg/ ngày 4
1994: Pantoprazole 20-40 mg/ ngày 2
1999: Rabeprazole 10-20 mg/ ngày 5
-
- 2001: Esomeprazole 20-40 mg/ ngày
2009: Dexlansoprazole
- Imidazopyridines
Tenatoprazole 1
Độ ổn định a-xít từ cao đến thấp nhất *,**
** Shin JM, et al 2008. The gastric HK-ATPase: Structure, function, and inhibition. Pflügers Archiv – European Journal of Physiology 457 3: 609–22.
* Shin JM, et al 1993. “The site of action of pantoprazole in the gastric H+/K+-ATPase”. Biochimica et Biophysica Acta 1148 2: 223–33.
Dược động học của PPI ở người lớn
Thuốc Liều thử nghiệm Thời gian đạt đỉnh (giờ) Cmax (g/mL) AUC0-24 (mg•h/L)
T½ (giờ) pKa Omeprazole (viên nang phóng thích chậm) 20 mg 1 lần/ngày
0.5-3.5 0.7 3.3 0.5-3 4.0 Lansoprazole 30 mg 1 lần/ngày
1.5-3 0.5-1.0 3.2 0.9-1.5 4.0 Pantoprazole 40 mg 1 lần/ngày
2-2.5 2.5 5.0 1 (3.5-10 giờ ở người
CYP2C19
chuyển hóa kém)
3.9 Rabeprazole 20 mg 1 lần/ngày
2-5 0.4-0.48 0.9 1-2 5.0 Esomeprazole 20 mg 1 lần/ngày
1-1.6 2.1 (mol/L) 4.2 (mol•h/L)
1.2-2.5 4.0 Dex- lansoprazole 30 mg 1 lần/ngày
1-2 (đỉnh 1) 4-5 (đỉnh 2)
0.7 3.3 1-2 Not available 2018 UpToDate
Omeprazole 45% (liều đầu), hấp thu tăng sau nhiều liều; sinh khả dụng khác nhau tùy dạng thuốc
Lansoprazole 85% (khi uống lúc bụng đói), hấp thu bị giảm ~50% khi uống kèm với thức ăn
Pantoprazole 77% Rabeprazole 52% Esomeprazole 64% (liều đầu), 90% (sau nhiều liều khi uống lúc bụng đói);
độ sinh khả dụng ~50% khi uống kèm thức ăn
Dexlansoprazole Hấp thu mức độ tương tự khi bụng đói và ăn 2018 UpToDate
Omeprazole Gan: CYP2C19* và 3A4; những sản phẩm chuyển hóa (không hoạt động) được thải trừ trong phân qua mật và trong nước tiểu Lansoprazole Pantoprazole Rabeprazole Esomeprazole Dexlansoprazole * Chuyển hoá thuốc qua enzym CYP2C19 gan đa hình; nồng độ PPI tuần hoàn (AUC0-24) có thể tăng 2-12 lần ở bệnh nhân chuyển hóa kém hoặc trung gian (hầu hết bệnh nhân).
15-20% người gốc châu Á kiểu hình CYP2C19 chuyển hóa kém
2018 UpToDate
THUỐC ỨC CHẾ BƠM PROTON
- ức chế giai đoạn cuối sản xuất a-xít
- ức chế không hồi phục bơm proton
- hấp thu nhanh
- đạt nồng độ cao nhất /máu sau uống 1-3 giờ
- chuyển hóa chủ yếu ở gan
- thời gian bán hủy 60-90 phút
- tác động ức chế a-xít kéo dài >24 giờ
- tác động tăng khi dùng liều lặp lại
- hoạt tính huyết thanh trở lại sau ngừng thuốc 1-5 ngày
 The CYP isoenzymes participating in the metabolism of PPI
The CYP isoenzymes participating in the metabolism of PPI Tác dụng phụ do sử dụng PPI dài hạn ?
Haastrup PF et al. Side Effects of Long‐Term Proton Pump Inhibitor Use: A Review.
Basic Clin Pharmacol Toxicol. 2018 Aug;123(2):114-121
Nhiễm trùng do giảm toan Viêm đại tràng Clostridium difficile Nhiễm trùng đường ruột
Viêm phúc mạc nhiễm khuẩn nguyên phát Bệnh não gan
Viêm phổi cộng đồng
Giảm hấp thu do giảm toan Gãy xương Thiếu vitamin B12 Hạ magne máu
Thiếu sắt
Tăng gastrin máu do PPI Tăng sản/chuyển sản dạ dày Tăng tiết acid rebound Tác dụng phụ khác Bệnh thận và tổn thương thận cấp Chứng mất trí Adverse events of Long-term PPI Use
Kinoshita Y, et al. Advantages and Disadvantages of Long-term Proton Pump Inhibitor Use.
J Neurogastroenterol Motil 2018 Apr 30;24(2):182-196
Unrelated to acid inhibition Related to acid inhibition Allergic reaction to drug chemicals Collagenous colitis Acute interstitial nephritis Chronic kidney disease Drug interaction Dementia
Cerebral ischemic diseases
Ischemic cardiac diseases
Pneumonia Gastrointestinal infection Gastric carcinoid tumor Gastric fundic mucosal hypertrophy Changes in gut microbiome
Small intestinal bacterial overgrowth
Iron deficiency
Bone fracture
Vitamin B12 deficiency Hypomagnesemia
Gastric fundic gland polyps Gastric cancer
Colon cancer
Spontaneous bacterial peritonitis
Hepatic encephalopathy Drug interaction
THUỐC ỨC CHẾ THỤ THỂ CHOLINE

-
- ức chế các thụ thể acetylcholine có tác dụng muscarine ở tế bào thành
- không có tác dụng liền sẹo nhanh
- tác động kháng muscarinic M1 & M2
- Banthine: 20-30mg x 3 lần/ngày
- Probanthine: 20-30mg x 3 lần/ngày
- tác động ức chế M (chủ yếu M1)
- Pirenzepine: 20-30mg x 3 lần/ngày
- Chống chỉ định
- Tăng nhãn áp
- Bướu lành tiền liệt tuyến
- Hẹp môn vị
- Sucralfate
THUỐC
TĂNG BẢO VỆ NIÊM MẠC
-
-
- Misoprostol
- Bismuth
- Rebamipide
-
- Sucralfate
- phức hợp của sucrose sulfat nhôm
- không ảnh hưởng cung lượng dạ dày
- không ảnh hưởng nồng độ a-xít dạ dày
- được hoạt hóa trong môi trường a-xít
- không dùng trong suy thận, do một lượng nhỏ nhôm được hấp thu vào máu
- không phối hợp với antacid nhôm
- Cơ chế tác động
– nhanh chóng tác động với HCl
chất giống như hồ dính, nhầy, đặc
đệm a-xít, gắn kết bề mặt ổ loét
bảo vệ ổ loét không bị tác động của pepsin, a-xít, mật
– kích thích sản xuất prostaglandin E2
- Thời gian – Liều – Tác dụng phụ
- hấp thu: rất ít qua đường tiêu hóa
- thời gian tác động tùy thuộc thời gian thuốc tiếp xúc với nơi tổn thương
- thời gian thuốc gắn kết ổ loét 6 giờ
- liều cấp: 1g x 4 lần/ngày lúc bụng đói
- liều duy trì: 1g x 2 lần/ngày
- tác dụng phụ: táo bón
MISOPROSTOL
- Chỉ định khi dùng NSAID cho những BN
- nguy cơ cao bị biến chứng của loét dạ dày
- nguy cơ cao loét dạ dày
- tiền căn loét dạ dày
- Mục đích sử dụng misoprostol
nguy cơ LDD do thuốc NSAID


×
- NSAID ức chế tổng hợp prostaglandin
tiết nhầy & bicarbonate tổn thương niêm mạc
- Misoprostol: prostaglandin E1 tổng hợp
- Misoprostol: prostaglandin E1 tổng hợp
- ức chế tiết acid của tế bào thành do ức chế thụ thể G-protein của adenylate cyclase
- Misoprostol: prostaglandin E1 tổng hợp
nồng độ AMPc nội bào và hoạt động của bơm proton tế bào thành
-
-
- bảo vệ niêm mạc dạ dày: liều thấp kích
-
thích tiết chất nhầy và lưu lượng máu niêm mạc tính toàn vẹn niêm mạc
- Chống chỉ định
- dị ứng prostaglandin
- có thai
- Tác dụng phụ
- đau bụng 7 – 20%
- tiêu chảy 13 – 40%
- buồn nôn 3%
- gây quái thai trong 3 tháng đầu thai kì
- tăng co thắt cơ tử cung
- Cơ chế tác động
- pH dạ dày <5 thuốc kết tủa thành vi tinh thể bismuth oxychloride & bismuth citrate tạo nối chelate bền vững, hình thành màng bảo vệ che phủ vết loét, ngăn cản tác động của H+ & pepsine
- Gắn với glycoprotein của màng nhầy tạo phức hợp ngăn cản sự trào ngược của H+, không ảnh hưởng đến sự trao đổi ion H+
- bicarbonate tá tràng, tiết nhầy, tiết PGE2 & hoạt động của prostaglandin
- Cơ chế tác động
- Có tác dụng diệt khuẩn trực tiếp
- Gắn vào màng của vi khuẩn
- Ức chế enzyme của vi khuẩn: urease, catalase, lipase, phospholipase
- Ức chế tổng hợp ATP của vi khuẩn
- Hóa không bào khiến vi khuẩn mất khả năng bám dính niêm mạc
- Giảm khả năng kích hoạt pepsine của pentagastrine
- Có tác dụng diệt khuẩn trực tiếp
- Cơ chế tác động
- Hấp thu – Chống chỉ định
- Tác động tại chỗ là chủ yếu
- Hấp thu qua đường tiêu hóa lượng rất nhỏ, tùy thuộc liều ban đầu & đạt đỉnh sau 4 tuần. Với liều điều trị 480 mg/ngày, nồng độ bismuth máu trung bình ~ 7 ng/ml, nồng độ báo động 50-100 ng/ml
- Chống chỉ định: suy thận nặng
- Liều bismuth subcitrat
- Loét: 120 mg (4 lần), 240 mg (2 lần) /ngày
- Điều trị H pylori: 120-300 mg, 4 lần /ngày
- Uống trước bữa ăn hoặc sau ăn 2 giờ
- Thời gian 4 tuần, có thể kéo dài 8 tuần
- Tương tác
- hấp thụ sắt, calci, tetracyclin
- Omeprazol hấp thu bismuth gấp 3 lần
ĐIỀU TRỊ PHỐI HỢP
-
-
- Thuốc chống co thắt
- Atropin
- Spasmaverin, Nospa
- Buscopan
- Chống chỉ định
- Xuất huyết tiêu hóa
- Tăng nhãn áp
- Bướu lành tiền liệt tuyến
- Thuốc chống co thắt
-
- Valium Seduxen 5-10 mg/ ngày
- Librax
- Tranxene
- B1, B6: co thắt môn vị
- A: bảo vệ niêm mạc dạ dày
- C, U: liền sẹo ổ loét
ĐIỀU TRỊ TIỆT TRỪ H.pylori
YÊU CẦU CỦA THUỐC ĐIỀU TRỊ H.pylori
Đạt hiệu quả tiệt trừ >80%
-
-
- Đơn giản, an toàn
-
Dung nạp tốt, ít tác dụng phụ
ĐIỀU TRỊ ĐẠT HIỆU QUẢ CAO
- Dùng thuốc ức chế toan mạnh qua cơ chế thể dịch & T½ chậm thường chọn PPI
- Kháng sinh: ít nhất 2 loại trở lên
- chọn KS ít bị phá hủy trong acid/dạ dày
- có tác dụng hiệp đồng
- lưu lại trong dạ dày càng lâu càng tốt
- có khả năng kháng thuốc thấp
LỰA CHỌN ĐIỀU TRỊ TIỆT TRỪ H.pylori
- Phác đồ chọn hàng đầu
- Phác đồ bốn thuốc có bismuth hoặc
- PPI, clarithromycin, amoxicillin, metronidazole
- Khi phác đồ hàng đầu thất bại, phác đồ cứu vãn tránh các kháng sinh đã sử dụng
- Nếu đã điều trị hàng đầu có clarithromycin phác đồ bốn thuốc có bismuth hoặc phác đồ cứu vãn levofloxacin
- Nếu đã điều trị hàng đầu 4 thuốc có bismuth, phác đồ cứu vãn clarithromycin / levofloxacin
Treatment of Helicobacter pylori Infection ACG 2017
Điều trị nhiễm H.pylori lần đầu
Phác đồ Thuốc Liều Thời gian FDA 3 thuốc PPI (liều chuẩn hoặc liều gấp đôi) 2 lần/ngày 14 ngày (+) subsalicylate (300 mg)
Clarithromycin (500 mg) Amoxicillin (1 g) hoặc Metronidazole (500 mg X 3 lần/ngày)
4 thuốc PPI (liều chuẩn) 2 lần/ngày 10–14 (–) Bismuth subcitrate (120–300 mg) hoặc 4 lần/ngày Tetracycline (500 mg) 4 lần/ngày Metronidazole (250 mg 4 lần/ngày) (500 mg 3 đến 4 lần/ngày)
4 thuốc PPI (liều chuẩn) 2 lần/ngày 10–14 (–) Clarithromycin (500 mg) Amoxicillin (1 g) Nitroimidazole (500 mg)* * Metronidazole hoặc Tinidazole Chey WD. ACG Clinical Guideline: Treatment of Helicobacter pylori Infection. 60
The American Journal of Gastroenterology, V 112, february 2017
Điều trị nhiễm H.pylori lần đầu
Phác đồ Thuốc Liều Thời gian FDA Nối tiếp PPI (liều chuẩn) + Amoxicillin (1 g) 2 lần/ngày 5–7 (–) PPI, Clarithromycin (500 mg) + Nitroimidazole (500 mg)*
2 lần/ngày 5–7
61
Lai PPI (liều chuẩn) + Amoxicillin (1 g) 2 lần/ngày 7 ngày (–) PPI, Amox, Clarithromycin (500 mg) + Nitroimidazole (500 mg)* 2 lần/ngày 7 ngày Levofloxacin PPI (liều chuẩn) 2 lần/ngày 10–14 (–) Levofloxacin (500 mg) 1 lần/ngày Amoxicillin (1 g) 2 lần/ngày Levofloxacin nối tiếp PPI (liều chuẩn/ liều gấp đôi) + Amox (1 g) 2 lần/ngày 5–7 (–) PPI, Amox, Levofloxacin (500 mg 1 lần/ngày) + Nitroimidazole (500 mg)* 2 lần/ngày 5–7 LOAD Levofloxacin (250 mg) 1 lần/ngày 7–10 (–) PPI (liều gấp đôi) 1 lần/ngày Nitazoxanide (500 mg) 2 lần/ngày Doxycycline (100 mg) 1 lần/ngày Phác đồ Thuốc Liều Thời gian FDA 4 thuốc Bismuth PPI (liều chuẩn) 2 lần/ngày 14 ngày (–) Bismuth subcitrate (120–300 mg)
4 lần/ngày
hoặc subsalicylate (300 mg) Tetracycline (500 mg) 4 lần/ngày Metronidazole (500 mg) 3–4 lần/ngày 3 thuốc Levoffloxacin
PPI (liều chuẩn) 2 lần/ngày 14 ngày (–) Levofloxacin (500 mg) 1 lần/ngày Amoxicillin (1 g) 4 lần/ngày 4 thuốc PPI (liều chuẩn) 2 lần/ngày 10–14 (–) Clarithromycin (500 mg) 2 lần/ngày Amoxicillin (1 g) 2 lần/ngày Nitroimidazole (500 mg) * 2–3 lần/ngày Chey WD. ACG Clinical Guideline: Treatment of Helicobacter pylori Infection. 62
The American Journal of Gastroenterology, V 112, february 2017
Phác đồ Thuốc Liều Thời gian FDA 3 thuốc Rifabutin PPI (liều chuẩn) 2 lần/ngày 10 ngày
(–) Rifabutin (300 mg) 1 lần/ngày
Amoxicillin (1 g) 2 lần/ngày
2 thuốc liều cao
PPI (liều chuẩn đến liều gấp đôi) 3–4
lần/ngày
14
ngày
(–)
Amoxicillin (1 g, 3 lần/ngày hoặc
750 mg, 4 lần/ngày)
3–4
lần/ngày
Chey WD. ACG Clinical Guideline: Treatment of Helicobacter pylori Infection. 63
The American Journal of Gastroenterology, V 112, february 2017
THỜI GIAN ĐIỀU TRỊ
Thời gian sử dụng kháng sinh tiệt trừ H.pylori
10 ngày – 14 ngày
Thời gian sử dụng thuốc ức chế a-xít điều trị lành loét
Loét dạ dày: 12 tuần Loét tá tràng: 8 tuần
KIỂM TRA H.pylori SAU ĐIỀU TRỊ
 Tỉ lệ tiệt trừ thành công <80%
Tỉ lệ tiệt trừ thành công <80%- Thử nghiệm urease nhanh:
 ngưng kháng sinh 4 tuần, PPI 2 tuần
ngưng kháng sinh 4 tuần, PPI 2 tuần- Khảo sát mô học
- Nuôi cấy

 PCR: định týp H.pylori
PCR: định týp H.pylori
KIỂM TRA H.pylori SAU ĐIỀU TRỊ
- HTCĐ H.pylori: không có giá trị
 Tìm kháng nguyên trong phân
Tìm kháng nguyên trong phân- Thở Urea
ngưng kháng sinh 4 tuần ngưng thuốc PPI 2 tuần
NỘI SOI KIỂM TRA LÀNH LOÉT SAU ĐIỀU TRỊ
- Loét dạ dày
Nội soi kiểm tra sau 8 tuần điều trị
LOÉT TRƠ
Loét không lành sau điều trị
NGUYÊN NHÂN
-
- Không tuân thủ dùng thuốc
- Tiếp tục hút thuốc lá, nhiễm H.pylori, sử dụng kháng viêm NSAID /aspirin,
- Loét ác tính, nhất là loét dạ dày
- Loét thủng bít vào gan, tụy
- Hội chứng tăng tiết a-xít: Zollinger-Ellison
- Loét do bệnh không liên quan tiết a-xít bệnh Crohn, amyloidosis, lymphoma
ĐIỀU TRỊ NGOẠI KHOA
Trong y văn
- Nối vị tràng: tái phát cao 30-50%
- Cắt dạ dày: tái phát thấp 3%, nhiều biến chứng
- Cắt thần kinh X: tái phát 10%
- Xuất huyết tiêu hóa điều trị nội thất bại
- Thủng ổ loét
- Hẹp môn vị
- Ung thư dạ dày
- Viêm tụy cấp do thủng ổ loét vào tụy
- Điều trị lành loét
- Điều trị tiệt trừ H.pylori
- Thay đổi lối sống
- Phòng ngừa
- Thức ăn trung hòa dịch vị 30-60 phút
- Ăn nhiều bữa ăn nhỏ trong ngày
- Bữa ăn tối không muộn & no quá
- Ngưng rượu
- Ngưng hút thuốc
Hút thuốc làm loét khó lành & dễ tái phát
- Thuốc: NSAID, corticoid, reserpine…
- Nhập viện? Loại bỏ stress
- Không hút thuốc/ Ngừng hút thuốc
- Tiết chế rượu bia
Không uống rượu bia lúc bụng đói
- Bệnh nhân có tiền căn loét, cần sử dụng NSAID nên được kiểm tra H.pylori, nếu có nhiễm H.pylori nên điều trị tiệt trừ
- Tránh sử dụng aspirin, ibuprofen, NSAID kéo dài
- Nếu sử dụng aspirin thường xuyên vì bệnh tim mạch, cần bảo vệ dạ dày tránh loét
ÜU H@h ris#

Table 1. Pa ients at incrœsed rish for N3AID GI toxicûy
- Hidary ofa pevieusÇ œmplicated ulcer, especôlly rœect
Frankl 2. MuRige (>2) risk factors
Come
A„ ; Böderale rish fl —2 rish IacloisJ
- High dæe NSAID theapy
- A peùous histaryÖ unEemplËated ulcer
- Concurmnt use Æ æpïûn {inEluding law dDSe) coÊÏEosleraids
OU Î3UtÏEDBgUÖFÊS
Low riÆ
1. No risk factors
H. (g#on is an indR{enderit and ælditire risk factor and needs & be addressed æpaæ&g (see text ard recommendab0ns).
ameters
Bệnh nhân có nguy cơ bị
tổn thương đường tiêu hóa do NSAID
High risk: Nguy cơ cao
- Tiền căn loét có biến chứng, nhất là mới xảy ra
- Nhiều hơn 2 yếu tố nguy cơ
Moderate risk: NC trung bình 1 – 2 yếu tố nguy cơ
- Tuổi >65
- Điều trị NSAID liều cao
- Tiền căn bị loét không có biến chứng
- Sử dụng đồng thời aspirin, corticosteroid, kháng đông
Low risk: Nguy cơ thấp
Không có yếu tố nguy cơ
H. pylori is an independent and additive risk factor and needs to be addressed separately

Diagnosis and Treatment of Peptic Ulcer Disease and H. pylori Infection. Fashner J, Gitu AC. Am Fam
Physician 2015 Feb15; 91 4: 236-42.
Chỉ định điều trị và kiểm tra H.pylori

Tất cả những bệnh nhân có thử nghiệm H.pylori (+) CẦN ĐƯỢC ĐIỀU TRỊ
Bệnh nhân nào nên thử nghiệm H.pylori?
- Loét dạ dày hoặc loét tá tràng hoạt động, tiền căn LDD/ LTT (trừ khi đã điều trị nhiễm H.pylori), lymphoma dạng MALT, tiền căn cắt ung thư dạ dày sớm qua nội soi
nên thử nghiệm H.pylori. Thử nghiệm (+): điều trị
- Tuổi <60, rối loạn tiêu hóa, không triệu chứng báo động
nên thử nghiệm không xâm lấn H.pylori. Thử nghiệm (+): điều trị
Chey WD. ACG Clinical Guideline: Treatment of Helicobacter pylori Infection.
78
The American Journal of Gastroenterology, V 112, February 2017
Chỉ định điều trị và kiểm tra H.pylori

- Khi nội soi dạ dày bệnh nhân bị chứng khó tiêu nên thử nghiệm H.pylori. Thử nghiệm (+): điều trị
- Bệnh nhân sử dụng aspirin liều thấp, lâu dài
thử nghiệm H.pylori để xác định nguy cơ chảy máu do loét. Thử nghiệm (+) nên điều trị tiệt trừ
- Bệnh nhân có triệu chứng điển hình của bệnh trào ngược dạ dày thực quản, không có tiền căn loét dạ dày tá tràng, không cần thử nghiệm nhiễm H.pylori.
Tuy nhiên, nếu thử nghiệm (+), cần điều trị
Chey WD. ACG Clinical Guideline: Treatment of Helicobacter pylori Infection.
79
The American Journal of Gastroenterology, V 112, February 2017
Chỉ định điều trị và kiểm tra H.pylori

- Bắt đầu điều trị NSAID lâu dài
nên thử nghiệm H.pylori. Thử nghiệm (+): điều trị
- Thiếu máu thiếu sắt không rõ nguyên nhân
nên thử nghiệm H.pylori. Thử nghiệm (+): điều trị
- Người lớn bị ban xuất huyết giảm tiểu cầu vô căn nên thử nghiệm H.pylori. Thử nghiệm (+): điều trị
- Không đủ bằng chứng ủng hộ thử nghiệm thường quy và điều trị H.pylori ở người không triệu chứng có tiền căn gia đình bị ung thư dạ dày hoặc viêm dạ dày tăng lymphocyte, polyp dạ dày tăng sản và chứng
tăng sản
Chey WD. ACG Clinical Guideline: Treatment of Helicobacter pylori Infection.
80
The American Journal of Gastroenterology, V 112, February 2017
Take home message
- Thuốc ức chế thụ thể Histamin H2
- Thuốc ức chế bơm proton
- Thuốc tăng cường bảo vệ niêm mạc dạ dày
- Điều trị tiệt trừ H. pylori
- Kiểm tra, đánh giá sau điều trị
- Nguyên tắc điều trị, phòng ngừa
Võ Thị Mỹ Dung
-
-
Điều trị xơ gan mất bù và ngăn ngừa tiến triển
ĐẠI CƯƠNG
- Điều trị lý tưởng ở bệnh nhân xơ gan mất bù là ngăn ngừa xơ gan tiến triển, không phải là điều trị biến chứng
- Điều trị tối ưu xơ gan mất bù chủ yếu nhằm vào những thay đổi bệnh lý trong gan với mục đích khôi phục lại tính toàn vẹn cấu trúc gan bằng cách
- ức chế viêm
- đẩy lùi xơ hóa
- cân đối tuần hoàn cửa và động mạch
- bình thường hóa số lượng và chức năng tế bào
Tế bào bị tổn thương Mô hình phân tử liên quan tổn thương
Những cơ chế
khác
Tăng áp cửa
Kích hoạt
thụ thể nhận dạng bẩm sinh
Sự chuyển chỗ vi khuẩn
Tổn thương gan
Phóng thích các phân tử tiền viêm
++
Giãn tiểu động mạch tạng, rối loạn chức năng tim mạch
năng thận
Rối loạn chức năng thượng thận
Sinh bệnh của xơ gan mất bù
Bernardi M. J Hepatol 2015;63:1272–1284
Xơ gan
Bệnh não gan Rối loạn chức
Hội chứng gan thận
Tổn thương thận cấp
Báng bụng
HCGT
Vàng da
Suy gan
Bệnh não gan
Xơ gan mất bù
Tăng áp cửa
Xơ gan
còn bù
XHTH
VPMNKNP
HCC
HCC
1 điểm 2 điểm 3 điểm Bệnh não gan Báng bụng Bilirubin máu
Albumin máu TQ kéo dài
không không < 2 mg/dl
> 3,5 g/dl
< 4’’
độ 1–2 ít 2–3 2,8–3,5
4–6”
độ 3–4 trung bình, nhiều
> 3
< 2,8
> 6”
Hoặc INR < 1,7 1,7–2,2 > 2,2 XG ứ mật Bili < 4 4–10 > 10 KHẢ NĂNG SỐNG CÒN NGUY CƠ PHẪU THUẬT THEO CHILD-PUGH
Child-Pugh A B C Điểm CTP 5–6 7–9 10–15 Tuổi thọ (năm) 15–20 4–14 1–3 Tử vong chu phẫu (%) 10 30 80 Schuppan D, Afdhal NH. Liver cirrhosis 2008
- EASL clinical practice guidelines on the management of ascites, spontaneous bacterial peritonitis, and hepatorenal syndrome in cirrhosis. J Hepatol 2010;53:397–417
- Lach J, et al. Prognostic value of arterial pressure, endogenous vasoactive systems, and renal function in cirrhotic patients admitted to the hospital for the treatment of ascites. Gastroenterology 1988;94:482–487.
- Schuppan D, Afdhal NH. Liver cirrhosis 2008
- Caregaro L, et al. Limitations of serum creatinine level and creatinine clearance as filtration markers in cirrhosis. Arch Intern Med 1994;154:201–205. 9
- Bernardi M, et al. The MELD score in patients awaiting liver transplant: strengths and weaknesses. J Hepatol 2011;54:1297–1306.
- Xơ gan có báng bụng tiên lượng xấu, tỷ lệ tử vong 1 và 2 năm ♯ 40 và 50%, theo thứ tự 1
- Hạ natri máu, huyết áp động mạch thấp, độ lọc cầu thận và bài tiết Na niệu thấp: yếu tố tiên lượng tử vong độc lập ở bệnh nhân xơ gan báng bụng 2
- Điểm Child-Pugh 3
- Mô hình bệnh gan giai đoạn cuối (MELD) 4
- Điểm MELD-Na và MELD-báng bụng 5
- Tùy thuộc biến chứng
- Điều trị chung xơ gan mất bù:
- Ngăn chặn các yếu tố căn nguyên
- Tác động lên các yếu tố đích của bệnh sinh mất bù và tiến triển của xơ gan
- Loại bỏ các yếu tố căn nguyên gây tổn thương gan
- Nền tảng quan trọng trong điều trị xơ gan
- Hiệu quả trong việc ngăn ngừa mất bù
- Cải thiện kết cục ở bệnh nhân xơ gan còn bù
10
ĐIỀU TRỊ XƠ GAN MẤT BÙ
EASL Clinical Practice Guidelines: Management of alcohol-related liver disease.
Journal of Hepatology 2018 vol. 69 j 154–181
- Các bước tiếp cận giảm tiến triển của xơ gan
- Cải thiện trục gan-ruột nhằm vào bất thường vi sinh vật và sự chuyển chỗ vi khuẩn bằng kháng sinh (rifaximin)
- Cải thiện chức năng tuần hoàn hệ thống bị rối loạn (albumin)
- Giảm tình trạng viêm (statin)
- Giảm tình trạng tăng áp cửa (thuốc chẹn beta)
- Điều trị triệu chứng và biến chứng
11


ĐIỀU TRỊ BÁNG BỤNG DO XƠ GAN
12
1. Moore KP, Wong F, Gines P, Bernardi M, Ochs A, Salerno F, et al. The management of ascites in cirrhosis: report on the consensus conference of the International Ascites Club. Hepatology 2003;38:258–266.
2. Arroyo V, Gines P, Gerbes AL, Dudley FJ, Gentilini P, Laffi G, et al. Definition and diagnostic criteria of refractory ascites and hepato1r3enal
syndrome in cirrhosis. International Ascites Club. Hepatology 1996;23:164–176.
- Xơ gan bị báng bụng độ 2 hoặc 3 sống còn giảm
cân nhắc ghép gan khi xơ gan có báng bụng
- Báng bụng không biến chứng khi không bị
nhiễm trùng, kháng trị hoặc hội chứng gan thận
- Phân độ báng bụng
- Độ 1 – ít: phát hiện nhờ siêu âm
- Độ 2 – trung bình: bụng chướng vừa phải
- Độ 3 – lượng lớn: bụng chướng căng rõ
Chẩn đoán báng bụng
- Chọc dịch báng chẩn đoán tất cả bệnh nhân báng bụng độ 2 – 3 hoặc nhập viện vì báng bụng xấu hơn hoặc vì bất kỳ biến chứng nào của xơ gan
- Đo protein dịch báng để xác định nguy cơ VPMNKNP
- SAAG khi không rõ nguyên nhân báng bụng và/hoặc nghi ngờ nguyên nhân khác gây báng bụng
- Đếm tế bào để phân biệt báng bụng do bệnh ác tính
14
- Báng bụng độ 2 không biến chứng
- Nghỉ ngơi/giường có lợi trong điều trị báng bụng?
- Hạn chế natri
- Hạn chế natri vừa phải (80–120 mmol/ngày, tương ứng 4,6-6,9 g muối), tương đương với chế độ ăn không có muối và tránh các bữa ăn được chuẩn bị trước
- Tránh chế độ ăn có lượng natri rất thấp (<40 mmol/ngày) vì dễ bị các biến chứng do lợi tiểu và không tốt cho dinh dưỡng
- Hướng dẫn dinh dưỡng đầy đủ
- Báng bụng độ 2
- Thuốc lợi tiểu
- Báng bụng độ 2, lần đầu:
- Thuốc lợi tiểu
sử dụng 1 thuốc kháng mineralocorticoid
bắt đầu 100 mg/ngày, tăng dần 100 mg/ 72 giờ tối đa 400 mg/ngày nếu không đáp ứng
Nếu không đáp ứng ( cân <2 kg/tuần) hoặc kali máu, thêm furosemide 40 mg/ngày tăng dần đến tối đa 160 mg/ngày
-
-
- Báng bụng kéo dài/ tái phát: kháng mineralo- corticoid và furosemide, tăng liều tùy đáp ứng
- Đáp ứng furosemide kém, sử dụng Torasemide
-
- Báng bụng độ 2
- Thuốc lợi tiểu
- Giảm cân tối đa 0,5 kg/ngày nếu không phù và 1 kg/ngày nếu có phù
- Khi kiểm soát được báng bụng, nên giảm liều thuốc lợi tiểu đến mức thấp nhất có hiệu quả
- Trong những tuần đầu điều trị, cần theo dõi lâm sàng và sinh hóa máu thường xuyên, nhất là khi báng bụng lần đầu
- Thuốc lợi tiểu
- Báng bụng độ 2
- Ngừng thuốc lợi tiểu
- Ngừng thuốc lợi tiểu nếu: natri máu <125 mmol/L, TTTC, bệnh não gan xấu hơn / kéo dài, chuột rút
- Ngừng furosemide, nếu K+ máu <3 mmol/L
- Ngừng kháng mineralocorticoid, nếu K+ >6 mmol/L
- Truyền albumin hoặc baclofen (10 mg/ngày, mỗi tuần tăng 10 mg/ngày, đến 30 mg/ngày) đối với những bệnh nhân bị chuột rút
- Ngừng thuốc lợi tiểu
18
- Báng bụng độ 3 (lượng lớn)
- Chọc tháo dịch báng lượng lớn: xử trí hàng đầu đối với báng bụng lượng lớn, nên chọc tháo toàn bộ trong một lần duy nhất
- Chọc tháo dịch báng <5 lít, nguy cơ rối loạn tuần hoàn thấp. Chọc tháo dịch báng >5 L, nên tăng thể tích huyết tương bằng truyền albumin (8 g/L dịch báng), hiệu quả hơn so với các dịch tăng thể tích huyết tương khác
- Sau khi chọc tháo dịch báng, nên sử dụng lợi tiểu liều tối thiểu để ngăn ngừa báng bụng tái phát
- Chống chỉ định chọc tháo dịch báng
- Bệnh nhân không hợp tác
- Nhiễm trùng da vùng bụng tại vị trí chọc tháo
- Có thai
- Bệnh đông máu nặng (tăng tiêu sợi huyết hoặc đông máu nội mạch lan tỏa)
- Chướng ruột nặng
- Thuốc sử dụng đồng thời trong xơ gan báng bụng
- Không nên sử dụng NSAID vì có nguy cơ cao giữ natri, hạ natri máu và tổn thương thận cấp (TTTC)
- Không nên sử dụng các thuốc ức chế men chuyển angiotensin, đối kháng angiotensin II hoặc chẹn thụ thể α1-adrenergic vì tăng nguy cơ suy thận
- Không nên sử dụng kháng sinh aminoglycoside, vì tăng nguy cơ TTTC. Ngoại trừ trường hợp nhiễm khuẩn nặng không thể điều trị bằng các thuốc khác
- XGBB và chức năng thận bảo tồn, thuốc cản quang không liên quan đến tăng nguy cơ suy thận
Định nghĩa Báng bụng kháng trị thuốc lợi tiểu Diuretic-resistant ascites
Báng bụng không cải thiện/ tái phát sớm vì thiếu đáp ứng với hạn chế natri và điều trị lợi tiểu Báng bụng khó chữa với thuốc lợi tiểu Diuretic-intractable ascites
Báng bụng không cải thiện/ tái phát sớm vì có các biến chứng do thuốc lợi tiểu (ngăn cản việc sử dụng liều thuốc lợi tiểu hiệu quả) Tiêu chuẩn chẩn đoán Thời gian điều trị Bệnh nhân phải điều trị lợi tiểu liều cao (spironolactone 400 mg/ngày và furosemide 160 mg/ngày) ít nhất một tuần và chế độ ăn muối <90 mmol/ngày Thiếu đáp ứng Giảm cân <0,8 kg/ 4 ngày và lượng natri niệu < lượng natri ăn vào
Báng bụng tái phát sớm Báng bụng độ 2 hoặc 3 tái phát trong vòng 4 tuần kể từ khi bắt đầu điều trị Tiêu chuẩn chẩn đoán Báng bụng kháng trị Biến chứng do thuốc lợi tiểu - Bệnh não gan do thuốc lợi tiểu, không có bất kỳ yếu tố thúc đẩy nào khác
- Suy thận do thuốc lợi tiểu: creatinine máu tăng >100% đến giá trị >2 mg/dl ở bệnh nhân báng bụng đáp ứng với điều trị
- Hạ natri máu do thuốc lợi tiểu: giảm natri máu nhiều hơn 10 mmol/L đến giá trị natri máu <125 mmol/L
- Tăng hoặc giảm kali máu do thuốc lợi tiểu: kali máu >6 mmol/L hoặc <3 mmol/L
- Chuột rút
24
- Chọc tháo dịch báng lượng lớn lặp lại kèm albumin: điều trị hàng đầu đối với báng bụng kháng trị
- Nên ngừng thuốc lợi tiểu ở bệnh nhân báng bụng kháng trị bài tiết natri niệu ≤30 mmol /ngày
- Thận trọng khi sử dụng NSBB trong trường hợp báng bụng nặng hoặc kháng trị. Tránh sử dụng NSBB liều cao (propranolol >80 mg/ngày). Không khuyến cáo sử dụng carvedilol
NSBB: NonSelective Beta Blockers
- Bệnh nhân bị báng bụng kháng trị hoặc tái phát, hoặc chọc tháo không hiệu quả nên xem xét việc đặt shunt cửa chủ trong gan (TIPS)
- Đặt TIPS giúp cải thiện sống còn ở bệnh nhân báng bụng tái phát và cải thiện việc kiểm soát báng bụng ở bệnh nhân báng bụng kháng trị
- Sử dụng stent đường kính nhỏ, có phủ PTFE để giảm nguy cơ bệnh não gan và rối loạn chức năng do TIPS
- Thuốc lợi tiểu và hạn chế natri nên được tiếp tục sau đặt TIPS
TIPS: Transjugular Intrahepatic Portosystemic Shunt
- TIPS không được khuyến cáo trong trường hợp
- Bilirubin huyết thanh >3 mg/dl
- Số lượng tiểu cầu <75 x 109/L,
- Bệnh não gan độ ≥2 hoặc bệnh não gan mạn
- Nhiễm trùng đang hoạt động
- Suy thận tiến triển
- Tăng áp phổi hoặc rối loạn chức năng tâm trương hoặc tâm thu nặng
ĐIỀU TRỊ
VIÊM PHÚC MẠC NHIỄM KHUẨN NGUYÊN PHÁT
28


Nguy cơ nhiễm khuẩn trong xơ gan do nhiều yếu tố
- Rối loạn chức năng gan
- Thông nối cửa chủ
- Mất cân bằng vi sinh vật ở ruột
- Tăng chuyển chỗ vi khuẩn
- Rối loạn chức năng miễn dịch do xơ gan
- Những yếu tố di truyền
- Chọc dịch báng chẩn đoán VPMNKNP ở BN XGBB
- Lúc nhập viện để loại trừ VPMNKNP
- Bị xuất huyết tiêu hóa, sốc, sốt, có những dấu hiệu nhiễm khuẩn toàn thân, triệu chứng tiêu hóa
- Tình trạng gan và thận xấu hơn, bệnh não gan
- Nghi ngờ VPMNK thứ phát nếu
- cấy dịch báng nhiều loại vi khuẩn
- số lượng bạch cầu trung tính rất cao
- nồng độ protein dịch báng cao
- hoặc đáp ứng kém với điều trị
- Đếm số lượng bạch cầu trung tính dịch báng >250
/mm3 là cần thiết để chẩn đoán VPMNKNP
- Cấy dịch báng tại giường không phải là điều kiện tiên quyết để chẩn đoán VPMNKNP, tuy nhiên giúp hướng dẫn điều trị kháng sinh
- Cấy máu nên được thực hiện ở tất cả bệnh nhân nghi ngờ VPMNKNP, trước khi điều trị kháng sinh
- Bệnh nhân bị du khuẩn báng (bạch cầu trung tính
<250/mm3, cấy (+)) có dấu hiệu nhiễm trùng hoặc đáp ứng viêm toàn thân nên điều trị kháng sinh.
Nếu không, phải chọc dịch lần hai. Cấy lần hai (+), bất kể số lượng bạch cầu, nên điều trị kháng sinh
Jalan R, et al. Bacterial infections in cirrhosis: a position statement based on
the EASL Special Conference. J Hepatol 2013;60:1310–1324
32
Phụ thuộc vùng: giống nhiễm trùng bệnh viện nếu xuất độ vi khuẩn kháng đa thuốc cao hoặc nhiễm trùng huyết
VPMNKNP
do chăm sóc y tế
Carbapenem đơn thuần hoặc phối hợp daptomycin, vancomycin hoặc linezold nếu xuất độ vi khuẩn gram + kháng đa thuốc hoặc nhiễm trùng huyết
VPMNKNP
bệnh viện
VPMNKNP: viêm phúc mạc nhiễm khuẩn nguyên phát MDRO: vi khuẩn kháng đa thuốc
Cephalosporin thế hệ 3 hoặc piperacillin- tazobactam
VPMNKNP
mắc phải ở cộng đồng
VPMNKNP
- Kháng sinh theo kinh nghiệm bắt đầu ngay lập tức.
- Kháng sinh theo hướng dẫn bởi đặc tính đề kháng của vi khuẩn
- VPMNKNP cộng đồng, tùy vùng:
Tỷ lệ kháng khuẩn thấp: cephalosporin 3
Tỷ lệ kháng khuẩn cao: piperacillin/tazobactam hoặc carbapenem
- VPMNKNP do chăm sóc y tế & bệnh viện, tùy vùng: Tỷ lệ kháng đa thuốc thấp: piperacillin/tazobactam Tỷ lệ cao vi khuẩn sinh lactamase: carbapenem Tỷ lệ vi khuẩn Gr (+) đa kháng thuốc cao, phối hợp carbapenem với glycopeptide hoặc daptomycin
hoặc linezolid
33
Jalan R, et al. Bacterial infections in cirrhosis: a position statement based on
the EASL Special Conference. J Hepatol 2013;60:1310–1324
- Kiểm tra hiệu quả của điều trị kháng sinh: xét nghiệm dịch báng lần hai tại thời điểm 48 giờ sau điều trị. Nghi ngờ thất bại điều trị kháng sinh nếu triệu chứng và dấu hiệu lâm sàng xấu hơn và/hoặc số lượng bạch cầu hoặc không giảm rõ (ít nhất 25%) sau 48 giờ
- Thời gian điều trị ít nhất 5-7 ngày
- Mủ màng phổi nguyên phát được điều trị tương tự viêm phúc mạc nhiễm khuẩn nguyên phát
- Albumin (1,5 g/kg lúc chẩn đoán và 1 g/kg vào ngày thứ 3) được khuyến cáo ở bệnh nhân bị VPMNKNP
34
Dự phòng tiên phát: bệnh nhân có protein dịch báng <15 g/L, không có tiền căn bị VPMNKNP
- Dự phòng tiên phát với norfloxacin (400 mg/ngày) ở bệnh nhân
- Child-Pugh ≥9 và bilirubin huyết thanh ≥3 mg/dl, chức năng thận giảm hoặc
- Hạ natri máu
- Ngừng dự phòng Norfloxacin ở bệnh nhân có cải thiện lâm sàng kéo dài và hết báng bụng
Bệnh nhân bị VPMNKNP: dự phòng tái phát
- Norfloxacin (400 mg/ngày, uống) cho bệnh nhân hồi phục sau VPMNKNP
- Rifaximin không được khuyến cáo thay thế norfloxacin để dự phòng VPMNKNP tái phát
- Sau đợt điều trị VPMNKNP
- không xác định
- hết báng bụng
- Bệnh nhân nguy cơ cao
- trong thời gian nằm viện
- Đang bị xuất huyết tiêu hóa
- 7 ngày
- Sau đợt điều trị VPMNKNP
- Sau đợt điều trị VPMNKNP
- Norfloxacin 400 mg/ngày
- Ciprofloxacin 500-1.000 mg/ngày
- Trimethoprim-Sulfamethoxazole 960mg/ngày
- Đang bị XHTH
- Norfloxacin 400 mg X 2 lần/ngày X 7 ngày
- Ceftriaxone 1 g tiêm mạch/ngày X 7 ngày
EASL Clinical Practice Guidelines for the management of patients with decompensated cirrhos3is9.
Journal of Hepatology 2018 vol. xxx
- PPI có thể làm tăng nguy cơ bị VPMNKNP, nên giới hạn sử dụng đối với người có chỉ định rõ
- NSBB có thể gây bất lợi cho bệnh gan giai đoạn cuối bị rối loạn huyết động, cần theo dõi sát và điều chỉnh liều hoặc ngừng thuốc nếu có chống chỉ định
- Probiotic: không có bằng chứng có lợi
- Bệnh nhân hồi phục sau VPMNKNP có sống còn kém, cần cân nhắc để ghép gan


PHÒNG NGỪA XUẤT HUYẾT TIÊU HÓA
DO VỠ TĨNH MẠCH GIÃN
40
XUẤT HUYẾT TIÊU HÓA
- North Italian Endoscopic Club for the Study and Treatment of Esophageal Varices. Prediction of the first variceal hemorrhage in patients with cirrhosis of the liver and esophageal varices. A prospective multicenter study. N Engl J Med 1988;319:983–989.
- D’Amico G, et al. Competing risks and prognostic stages of cirrhosis: a 25-year inception cohort study of 494 patients. Aliment Pharmacol Ther 2014;39:1180–1193.
- Augustin S, et al. Predicting early mortality after acute variceal hemorrhage based on classification and regression tree analysis. Clin Gastroenterol Hepatol 2009;7:1347– 1354. 41
- Bosch J, et al. Prevention of variceal rebleeding. Lancet 2003;361:952–954
- Tỉ lệ tử vong chung mỗi đợt xuất huyết do tĩnh mạch giãn 15%-25% vào tuần thứ sáu. Nguy cơ tử vong ở những người xuất huyết kèm biểu hiện mất bù khác (>80% ở thời điểm 5 năm) cao hơn nhiều so với xuất huyết do tĩnh mạch giãn là biến cố mất bù đơn độc (20% ở thời điểm 5 năm) 6,7
- Nguy cơ tử vong cao khi kèm TTTC, VPMNKNP 8
- Không phòng ngừa, xuất huyết tái phát 60%-70%, thường trong vòng 1-2 năm sau xuất huyết 9
Tiếp cận điều trị xuất huyết tiêu hóa cấp ở bệnh nhân xơ gan
Xuất huyết tiêu hóa cấp + Tăng áp cửa
Đánh giá ban đầu


Airway Breathing Circulation
Bồi hoàn thể tích bằng dung dịch tinh thể/keo) Truyền máu duy trì Hb 7 g/dl, mục tiêu 7-9 g/dl
Chèn bóng/đặt stent thực quản
nếu xuất huyết lượng lớn
Điều trị ngay: somatostatin, terlipressin
KS phòng ngừa: ceftriaxone, norfloxacine
Nội soi chẩn đoán sớm (<12 giờ) Xác định xuất huyết do tĩnh mạch giãn
Điều trị qua nội soi (thắt tĩnh mạch)
+ duy trì thuốc co mạch 3-5 ngày
và phòng ngừa kháng sinh
De Franchis R. Expanding consensus in portal hypertension: report of the BAVENO VI Consensus Workshop: Stratifying risk and individualizing care for portal hypertension. J Hepa4t2ol
2015;63:743–752
Kiểm soát (~85%) Còn xuất huyết (~15%)
Cân nhắc TIPS sớm
TIPS cứu vãn


-
- Nội soi
- Thắt TMTQ
- Chích xơ TM phình vị
- Thuốc chẹn beta
- Nội soi
Nên nội soi thường qui
cho tất cả BNXG lần đầu
Child Pugh 7
Child Pugh > 7
Không giãn TM
Giãn TM nhỏ
Giãn TM lớn
Không, giãn nhỏ
NS: 2-3 năm
NS: 1 năm
Thắt, chẹn beta
NS: 1 năm
- Tĩnh mạch giãn nhẹ có dấu son hoặc Child-Pugh C điều trị NSBB (thuốc chẹn beta không chọn lọc)
- Tĩnh mạch giãn trung bình hoặc lớn điều trị NSBB hoặc thắt tĩnh mạch. Chọn lựa tùy khả năng tại chỗ, sự ưa thích của người bệnh, chống chỉ định và tác dụng phụ. NSBB có thể được ưa chọn hơn vì ngoài tác động giảm áp cửa còn có những tác động có lợi khác
- Báng bụng không phải là chống chỉ định sử dụng NSBB. Thận trọng trong những trường hợp báng bụng nặng hoặc kháng trị, tránh sử dụng NSBB liều cao, không sử dụng carvedilol
- Bệnh nhân bị hạ áp tiến triển (HAmax <90 mmHg) hoặc trong tình trạng cấp: xuất huyết, nhiễm trùng, VPMNKNP hoặc TTTC, ngừng NSBB
Sau khi hồi phục, có thể thử dùng lại. Nếu không dung nạp hoặc chống chỉ định NSBB hoặc có nguy cơ xuất huyết nên phòng ngừa xuất huyết bằng thắt tĩnh mạch giãn
-
- Phối hợp NSBB và thắt tĩnh mạch giãn giảm nguy cơ chảy máu tái phát tốt hơn so với đơn trị liệu
- Bệnh nhân không dung nạp NSBB, xem xét đặt TIPS, nếu không có chống chỉ định tuyệt đối
Cơ chế bệnh sinh Tăng áp cửa và
Vị trí hoạt động của các điều trị được khuyến cáo
AASLD 2017
 46
46Cơ chế tác động của NSBB / XG còn bù Cơ chế tác động của NSBB / XG mất bù
Carvedilol
1
1 2
Propranolol Nadolol
có lợi
tiềm ẩn có hại có hại
1 Carvedilol
1 Propranolol
Nadolol
Mất khả năng ino/chomotropic
2
Chống lại tăng cung lượng tim
Nhằm vào kháng trở mạch máu trong gan
Bảo tồn ino/chomotropic
Kháng trở trong gan
Tim
Giảm cung lượng tim
Nhằm vào kháng trở mạch máu trong gan
Dòng máu đến tạng
Giảm giãn mạch tạng
Giảm giãn mạch tạng
DOI: (10.1

Giảm dòng máu cửa
Giảm dòng máu cửa
Thận
Tuần hoàn hệ thống
Kháng trở mạch máu hệ thống giảm tiềm tàng nhưng huyết áp được duy trì.
Tưới máu thận thiếu, tốc độ lọc không đủ
Giãn mạch thận tiềm tàng nhưng tưới máu thận đủ
EASL 2018
Giãn mạch ngoại biên, hạ áp và rối loạn chức năng tuần hoàn
ournal of Hepatology 2017 66, 859 016 2016.11.001)
Thuốc chẹn beta không chọn lọc
- ức chế thụ thể beta trên các mạch máu tạng
cung lượng tim, dòng máu tĩnh mạch cửa
áp tĩnh mạch cửa
- kháng trở bàng hệ quanh hệ cửa dòng máu bàng hệ
- xuất huyết khi nhịp tim 25% nhịp cơ bản
- nguy cơ xuất huyết tiên phát khoảng 50%
- khoảng 1/3 bệnh nhân không dung nạp thuốc
- không ngăn ngừa hình thành giãn tĩnh mạch
Thuốc chẹn beta không chọn lọc (NSBB) Chống chỉ định thuốc Propranolol
-
- Hen, bệnh phổi tắc nghẹn mạn (COPD)
- Nhịp tim chậm <50 lần/phút
- Hội chứng suy nút xoang
- Blốc nhĩ thất độ 2 hoặc 3
- Sốc, hạ huyết áp nặng
- Suy tim sung huyết không kiểm soát được
Thuốc chẹn beta không chọn lọc (NSBB) Dược động học thuốc propranolol
-
- Hấp thu nhanh & hoàn toàn
- Đạt nồng độ đỉnh 1-3 giờ sau uống
- Tăng hoạt tính sinh học khi bị suy gan
- Thời gian bán hủy 3-4 giờ
- Có ái lực với mô mỡ
- Chuyển hóa thành 4-hydroxypropranolol, có hoạt tính dược lý, thời gian bán hủy 5,2-7,2 giờ
Thuốc chẹn beta không chọn lọc (NSBB) Tác dụng phụ
-
- Buồn nôn, tiêu chảy
- Co thắt phế quản, khó thở
- Lạnh đầu chi, hội chứng Raynaud nặng hơn
- Chậm nhịp tim, hạ huyết áp, suy tim
- Mệt mỏi, chóng mặt, thị lực bất thường
- tập trung, ảo giác, mất ngủ, ác mộng
- Rối loạn chuyển hóa glucose & lipid
Thuốc Liều đầu/ngày Liều điều trị/ngày Propranolol * 20-40 mg x 2 160 mg có báng bụng 320 mg báng bụng (-) Nadolol * 20-40 mg 80 mg có báng bụng 160 mg báng bụng (-) Carvedilol * 6,25 mg 6,25 mg x 2 - Garcia-Tsao G. Portal Hypertensive Bleeding in Cirrhosis. HEPATOLOGY, Vol. 65, No. 1,
2017. AASLD Practice Guidelines 2017
52
-
- Carvedilol không được khuyến cáo trong
- Phòng ngừa xuất huyết tái phát do tĩnh mạch giãn *
- Xơ gan báng bụng nặng hoặc kháng trị **
- Mục tiêu điều trị *
- Nhịp tim lúc nghỉ 55-60 lần/phút
- Huyết áp tâm thu không nên giảm <90 mmHg
- Carvedilol không được khuyến cáo trong
- Garcia-Tsao G. Portal Hypertensive Bleeding in Cirrhosis. HEPATOLOGY, Vol. 65, No. 1,
2017. AASLD Practice Guidelines 2017
** EASL Clinical Practice Guidelines for the management of patients with decompensated
53
cirrhosis. Journal of Hepatology 2018 vol. xxx
ĐIỀU TRỊ
TỔN THƯƠNG THẬN CẤP TRONG XƠ GAN
54

Nam, 38 t, 50 kg, 4 ngày nay: tiêu chảy, sốt, báng bụng độ 3, đau vùng rốn, nhập BVĐK tỉnh: creatinine máu 1,3 mg/dL, tiểu 100 ml/6 giờ, chẩn đoán xơ gan mất bù, sau 24 giờ chuyển BVCR. Tại BVCR: creatinine máu 1,63 mg/dL. Chẩn đoán bệnh nhân bị tổn thương thận cấp dựa tiêu chuẩn nào?
0%
- Creatinine máu
- Lượng nước tiểu
- Creatinine máu và lượng nước tiểu
0%
0%
Tiêu chuẩn chẩn đoán TTTC trong xơ gan
Angeli P et al. International Club of Ascites. Gut. 2015 Apr; 64(4):531-7
Thông số Định nghĩa
TTTC
Tăng Cr HT ≥26,4 μmoL/L (0,3 mg/dL) trong 48 giờ
hoặc tăng 50% so với giá trị nền
Thông số Định nghĩa
Cr HT nền Creatinine huyết thanh (Cr HT ổn định ≤3 tháng)
Nếu không có, trị số Cr HT gần nhất lần nhập viện này
Nếu trước đó không có, sử dụng Cr HT lúc nhập viện
TTTC: tổn thương thận cấp Cr HT: creatinine huyết thanh
Nam, 38 t, 4 ngày nay: tiêu chảy, sốt, báng bụng độ 3, đau vùng rốn, nhập BVĐK tỉnh: creatinine máu 1,3 mg/dL, chẩn đoán xơ gan mất bù, sau 24 giờ chuyển BVCR. Tại BVCR: creatinine máu 1,63 mg/dL. Bệnh nhân bị tổn thương thận cấp giai đoạn mấy?
0%
- 1
- 2
- 3
0%
0%
Tiêu chuẩn chẩn đoán TTTC trong xơ gan
Angeli P et al. International Club of Ascites. Gut. 2015 Apr; 64(4):531-7
Thông số Định nghĩa
Cr HT nền Creatinine huyết thanh (Cr HT ổn định ≤3 tháng)
Nếu không có, trị số Cr HT gần nhất lần nhập viện này Nếu trước đó không có, sử dụng Cr HT lúc nhập viện
Tổn thương thận cấp giai đoạn
1 Tăng Cr HT ≥26,4 μmoL/L (0,3 mg/dL) hoặc tăng Cr HT ≥1,5–2 × giá trị nền
2 Tăng Cr HT >2–3 × giá trị nền
3 Tăng Cr HT >3 × giá trị nền hoặc
Cr HT ≥352 μmoL/L (4 mg/dL) có ↑ cấp ≥26,4 μmoL/L
hoặc bắt đầu điều trị thay thế thận
Cr HT: creatinine huyết thanh
Nam, 38 t, 4 ngày nay: tiêu chảy, sốt, báng bụng độ 3, đau vùng rốn, nhập BVĐK tỉnh: creatinine máu 1,3 mg/dL, chẩn đoán xơ gan mất bù, sau 24 giờ chuyển BVCR. Tại BVCR: creatinine máu 1,63 mg/dL, sau 48 giờ: creatinine máu 1 mg/dL. Đáp ứng điều trị của tổn thương thận cấp thuộc nhóm nào?
0%
- Không đáp ứng
- Đáp ứng một phần
- Đáp ứng hoàn toàn
0%
0%
Định nghĩa đáp ứng của TTTC
Angeli P et al. International Club of Ascites. Gut. 2015 Apr; 64(4):531-7
Đáp ứng điều trị
Không TTTC không thoái lui
Một phần
Giai đoạn TTTC thoái lui với Cr HT giảm ≤0,3
mg/dL so với giá trị nền
Hoàn toàn Giảm Cr HT >0,3 mg/dL so với giá trị nền
Định nghĩa
Cr HT nền Creatinine huyết thanh (Cr HT ổn định ≤3 tháng)
Nếu không có, trị số Cr HT gần nhất lần nhập viện này Nếu trước đó không có, sử dụng Cr HT lúc nhập viện
60
TTTC: tổn thương thận cấp Cr HT: creatinine huyết thanh
Nam, 38 t, 4 ngày nay: tiêu chảy, sốt, báng bụng độ 3, khó thở khi nằm, đau vùng rốn, nhập BVĐK tỉnh: creatinine máu 1,3 mg/dL, uống Aldacton 100 mg và furosemide 40 mg, chẩn đoán xơ gan mất bù, sau 24 giờ chuyển BVCR. Tại BVCR: creatinine máu 1,63 mg/dL, K+ 3 mEq/L, HA 120/80 mmHg. Điều trị nào sau đây thích hợp nhất?
0%
- Giảm liều lợi tiểu
- Ngừng lợi tiểu
- Ngừng lợi tiểu & truyền dịch
- thể tích huyết tương bằng truyền dịch
0%
0%
61
0%
Có
Đáp ứng
Không
Tiếp cận điều trị TTTC ở bệnh nhân xơ gan
Angeli P, et al. J Hepatol 2015;62:968–974
TTTC giai đoạn 1
TTTC giai đoạn 2 và 3
- Theo dõi sát
- Loại bỏ yếu tố thúc đẩy (ngừng thuốc độc thận, thuốc giãn mạch, NSAID, giảm/ngừng thuốc lợi tiểu, điều trị nhiễm trùng)
- Tăng thể tích huyết tương, nếu có giảm thể tích
Ngừng thuốc lợi tiểu (nếu trước đó chưa ngừng) và tăng thể tích huyết tương bằng albumin (1 g/kg) trong 2 ngày
Thuốc co mạch và albumin
Điều trị đặc hiệu đối với thể TTTC
Tiếp tục điều trị TTTC
Có
Không
Theo dõi sát
Đáp ứng tiêu chuẩn HCGT
Tiến triển
Ổn định
Hồi phục
ĐIỀU TRỊ TỔN THƯƠNG THẬN CẤP
-
- Bù dịch tùy theo nguyên nhân và mức độ mất dịch
- Trường hợp không có nguyên nhân rõ của TTTC, TTTC giai đoạn >1A hoặc TTTC do nhiễm trùng, nên truyền albumin 20% liều 1 g albumin/kg trọng lượng cơ thể (tối đa 100 g) hai ngày liên tục
- Bệnh nhân TTTC và báng bụng lượng nhiều, chọc tháo dịch báng kèm truyền albumin ngay cả khi chọc tháo dịch báng lượng ít
63
Tiêu chuẩn chẩn đoán HCGT
Hội báng bụng quốc tế 2015
- Chẩn đoán xơ gan kèm báng bụng
- Chẩn đoán TTTC theo tiêu chuẩn TTTC của ICA
- Không đáp ứng sau 2 ngày liên tục ngừng thuốc lợi tiểu và tăng thể tích huyết tương = albumin 1 g/kg cân nặng
- Không sốc
- Không sử dụng các thuốc độc thận (NSAID, aminoglycoside, thuốc cản quang…)
- Không có dấu hiệu của tổn thương thận cấu trúc, như không có protein niệu (>500 mg/ngày), không có tiểu máu vi thể (>50 hồng cầu/quang trường phóng đại), thận bình thường trên siêu âm
Thuốc co mạch và albumin được khuyến cáo khi đủ tiêu chuẩn định nghĩa HCGT TTTC giai >1A
EASL Clinical Practice Guidelines for the management of patients with decompensated cirrhosis.
Journal of Hepatology 2018 vol. xxx
-
- Terlipressin và albumin được chọn hàng đầu trong điều trị HCGT. Telipressin tiêm thẳng tĩnh mạch liều đầu 1 mg mỗi 4-6 giờ hoặc truyền tĩnh mạch liều 2 mg/ngày. Trường hợp không đáp ứng (Cr huyết thanh giảm <25% so với giá trị đỉnh), sau 2 ngày, tăng liều terlipressin đến tối đa 12 mg/ngày
- Albumin 20% liều 20-40 g/ngày
Đo CVP hoặc các biện pháp khác đánh giá thể tích máu trung tâm, giúp ngăn ngừa quá tải tuần hoàn bằng cách tối ưu hóa cân bằng dịch và liều albumin
65
EASL Clinical Practice Guidelines for the management of patients with decompensated cirrhosis.
Journal of Hepatology 2018 vol. xxx
- Noradrenaline có thể là thuốc thay thế terlipressin. Sử dụng noradrenaline cần có đường truyền tĩnh mạch trung tâm
- Midodrine phối hợp octreotide là lựa chọn khi không có terlipressin hoặc noradrenaline, hiệu quả thấp hơn nhiều so với terlipressin
- Tác dụng phụ của terlipressin hoặc noradrenaline: thiếu máu cục bộ và biến cố tim mạch. Nên kiểm tra thường qui điện tâm đồ trước khi bắt đầu điều trị và theo dõi sát trong thời gian điều trị. Tùy loại và mức độ tác dụng phụ, thay đổi hoặc ngừng điều trị
66
PHÒNG NGỪA HỘI CHỨNG GAN THẬN
EASL Clinical Practice Guidelines for the management of patients with decompensated
cirrhosis. Journal of Hepatology 2018 vol. xxx
67
Khuyến cáo
- Albumin (1,5 g/kg lúc chẩn đoán và 1g/kg ngày thứ ba) được sử dụng cho người bị VPMNKNP để phòng ngừa hội chứng gan thận
- Norfloxacin (400 mg/ngày được sử dụng để phòng ngừa VPMNKNP phòng ngừa hội chứng gan thận
ĐIỀU TRỊ BỆNH NÃO GAN TRONG XƠ GAN

8
6
-
- Hội chứng rối loạn ý thức & thay đổi hoạt động thần kinh cơ
- Thường xảy ra ở trong suy tế bào gan cấp hoặc mạn hoặc có thông nối cửa chủ
- Cơ chế bệnh sinh còn tranh cãi &
có sự tham gia của nhiều chất trung gian
Phân độ bệnh não gan
- Độ I: thay đổi chu kì ngủ, hơi lú lẫn, dễ bị kích thích, run vẫy
- Độ II: ngủ lịm, mất định hướng, thái độ bất thường, run vẫy
- Độ III: lơ mơ, lú lẫn nặng, hung hăng, run vẫy
- Độ IV: hôn mê
Yếu tố thúc đẩy
- Tăng urê huyết
- Thuốc an thần, thuốc hướng tâm thần
- Dẫn xuất á phiện
- Xuất huyết tiêu hóa
- kali máu & kiềm máu (lợi tiểu, tiêu chảy)
- Chế độ ăn nhiều đạm, bón
- Nhiễm trùng
- Rối loạn chức năng gan tiến triển
- Thông nối cửa chủ (phẫu thuật, TIPS)
Chẩn đoán
-
- Biểu hiện đa dạng:
Thay đổi tâm thần kinh nhẹ hôn mê Run vẫy: bệnh não gan độ I-III,
triệu chứng không đặc hiệu
-
- EEG: sóng ba pha, chậm, biên độ cao
- Định lượng NH3 máu
không nhạy & không đặc hiệu
Mục tiêu điều trị
- Nhận biết & điều trị
nguyên nhân & yếu tố thúc đẩy
- Giảm sản xuất & hấp thu NH3 & các độc chất khác từ ruột:
- giảm & thay đổi đạm trong chế độ ăn
- thay đổi vi khuẩn đường ruột
- thay đổi môi trường đường ruột
- làm trống đường ruột
- Thay đổi dẫn truyền thần kinh
Điều trị yếu tố thúc đẩy
- Tránh sử dụng thuốc an thần
- Chống chỉ định Morphine, Paraldehyde
- Không sử dụng acid amin dạng uống
- Không dùng thuốc lợi tiểu
- Bổ sung kali
- Bổ sung kẽm
- XHTH: cầm máu, loại bỏ máu
Giảm sản xuất & hấp thu NH3
-
- Chế độ ăn
- Kháng sinh
- Lactulose
- Thụt tháo
Chế độ ăn
- Cơn cấp: đạm giảm còn 20 g/ngày
- Lượng calo >25-35 kcal/kg: miệng, tĩnh mạch
- Nếu hồi phục, tăng dần 10 g đạm /ngày
- Nếu tái phát, trở lại mức điều trị trước
- Đạm thực vật
- nếu không dung nạp đạm động vật
- ít sinh NH3, methionine, acid amin thơm
- nhuận trường hơn & tăng lượng chất xơ
- tăng sự hợp nhất & thải trừ nitơ qua phân
- gây đầy hơi, tiêu chảy & nhiều phân
Kháng sinh


- Neomycin sản xuất NH3 đường tiêu hóa Liều: 500-1000 mg mỗi 6 giờ
thụt giữ 100-200 mL dung dịch 1% Thời gian: 5-7 ngày
Phối hợp Lactulose có tác động hiệp lực 1-3% hấp thu, nguy cơ suy thận & độc tai
Kháng sinh
-
- Metronidazol 250 mg uống mỗi 6-8 giờ
- hiệu quả như neomycin
- độc tính trên hệ thần kinh trung ương
- Rifaximin
- không được hấp thu
- hiệu quả đối với bệnh não gan độ 1-3
- liều 400 mg uống 3 lần mỗi ngày
- Vancomycin 250mg X 4 /ngày
- sử dụng vancomycin khi kháng lactulose
- Metronidazol 250 mg uống mỗi 6-8 giờ
Lactulose
-
- -1,4-galactosido-fructose – dissacharide
- vi khuẩn ở ruột phân hủy thành a-xít lactic
- giảm pH của phân, phân có tính a-xít
- tăng khả năng thẩm thấu của đại tràng
- tạo thuận lợi cho sự phát triển của vi khuẩn lên men lactose
- ức chế vi khuẩn tạo NH3
- giảm quá trình ion hóa & hấp thu NH3
- rút ngắn diễn tiến bệnh của BNG sau XHTH
Lactulose
- Liều đầu: 15-45 ml uống 2-4 lần/ngày
- Liều duy trì điều chỉnh để
tiêu phân mềm 3-5 lần /ngày
- Không sử dụng khi liệt ruột, tắc ruột
- Tác dụng phụ
- đầy hơi, tiêu chảy, đau bụng
- tiêu chảy nặng: Na, K & kiềm máu
- thể tích máu , suy thận
Thụt tháo
- Bệnh não gan do bón:
giảm khi đi tiêu trở về bình thường
- Dịch thụt tháo: trung tính hoặc có tính acid để làm sự hấp thu NH3


- Thụt tháo bằng lactulose tốt hơn nước 300 mL lactulose + 700 mL nước nhỏ giọt
- Thụt tháo bằng MgSO4: tăng Mg máu
- Thụt tháo với Phosphate an toàn hơn Mg
Mục tiêu điều trị
Nhận biết & điều trị
nguyên nhân & yếu tố thúc đẩy
Giảm sản xuất, hấp thu NH3 & các độc chất khác từ ruột
- giảm & thay đổi đạm trong chế độ ăn
- thay đổi vi khuẩn đường ruột
- thay đổi môi trường đường ruột
- làm trống đường ruột Thay đổi dẫn truyền thần kinh
Thay đổi dẫn truyền thần kinh
- Benzoate natri & L-ornithine-L-aspartate


-
- Benzoate natri làm tăng bài tiết NH3 niệu


-
- L-ornithine-L-aspartate thúc đẩy gan loại NH3 kích thích hoạt động chu trình urea gan thúc đẩy tổng hợp glutamine
Thuốc: uống, tiêm tĩnh mạch


→ nồng độ NH3 & cải thiện bệnh não
Thay đổi dẫn truyền thần kinh
- Levodopa & Bromocriptine Bệnh não có thông nối cửa chủ
- Levodopa
tiền thân của Dopamine gây tình trạng thức tỉnh
-
- Bromocriptine
chất đối vận thụ thể Dopamine đặc hiệu cải thiện khả năng tâm thần & EEG
Thay đổi dẫn truyền thần kinh
- Flumazenil
- đối kháng thụ thể Benzodiazepine
 cải thiện rõ tình trạng thần kinh & EEG
cải thiện rõ tình trạng thần kinh & EEG- thời gian hoạt động rất ngắn
Thay đổi dẫn truyền thần kinh
- Các a-xít amin chuỗi ngắn Xơ gan
Các AA chuỗi ngắn , các AA thơm
Tỉ lệ AA chuỗi ngắn / thơm
Truyền dịch AA chuỗi ngắn nồng độ cao
→ kết quả khác nhau, do khác biệt về: Thành phần của các dung dịch AA Cách sử dụng
Đối tượng nghiên cứu
Những biện pháp khác
- Các phương pháp hỗ trợ gan tạm thời
- phức tạp
- không thích hợp với BNG do xơ gan
- Ghép gan: trị liệu cuối cùng
Thuốc và độc chất Rượu bia Methotrexate Amiodarone Vitamin A
Bệnh do chuyển hóa/di truyền Nhiễm sắt
Bệnh Wilson
Thiếu alpha1-antitrypsin
Viêm gan thoái hóa mỡ không do rượu
Viêm gan virus ĐIỀU TRỊ NGUĐYa ÊnanNg đưNờnHg mÂậtNbẩm sinh
Virus viêm gan B (±) D
Virus viêm gan C
Bệnh tự miễn
Viêm gan tự miễn
Xơ gan ứ mật tiên phát
Teo hẹp đường mật
GÂY XƠBGệnhAxơNhóa nang
Bất thường về mạch máu Hội chứng Budd-Chiari Suy tim phải
Viêm đường mật xơ hóa tiên phát
Căn nguyên khác
Bệnh gan thoái hóa hạt
Hội chứng tắc nghẽn xoang
Giãn mạch máu xuất huyết di truyền Xơ hóa tĩnh mạch cửa idiopathic
88
ĐIỀU TRỊ XƠ GAN DO RƯỢU
EASL Clinical Practice Guidelines: Management of alcohol-related liver disease.
Journal of Hepatology 2018 vol. 69 j 154–181
89
- Bệnh nhân xơ gan do rượu cần được khuyến cáo và khuyến khích để đạt được sự kiêng rượu hoàn toàn để giảm nguy cơ biến chứng và tử vong do gan
- Xác định và điều trị các yếu tố đồng thời, như béo phì và kháng insulin, suy dinh dưỡng, hút thuốc lá, quá tải sắt và viêm gan virus
- Sàng lọc và điều trị các biến chứng xơ gan nên được áp dụng đối với xơ gan do rượu
VIÊM GAN B MẠN TRÊN XƠ GAN CÒN BÙ
Xơ gan còn bù và lượng virus <2.000 IU/mL, nên được điều trị kháng virus để giảm nguy cơ mất bù, bất kể nồng độ ALT (AASLD 2018)
- Tenofovir và entecavir được ưu tiên vì hiệu lực và ít nguy cơ bị kháng thuốc, mất bù và tác dụng phụ nghiêm trọng. Thuốc kháng virus có hàng rào di truyền thấp với đề kháng không được khuyến cáo vì sự xuất hiện kháng thuốc có thể dẫn đến mất bù. TAF là thuốc kháng virus được ưu tiên bổ sung
- Peg‐IFN không chống chỉ định ở bệnh nhân xơ gan còn bù, nhưng NA an toàn hơn
- Nếu không điều trị, theo dõi tăng HBV DNA và/hoặc mất bù lâm sàng mỗi 3-6 tháng. Điều trị bắt đầu nếu xảy ra một trong hai
90
VIÊM GAN B MẠN TRÊN XƠ GAN CÒN BÙ
- ALT trong XG còn bù thường bình thường hoặc <2 lần so với giới hạn bình thường trên. ALT > 2 lần, tìm nguyên nhân khác ALT và nếu không tìm thấy, thì đó là chỉ định mạnh hơn cho điều trị kháng virus
- Chứng cứ hiện tại không cung cấp thời gian điều trị tối ưu. Nếu ngừng điều trị, theo dõi ít nhất 1 lần/3 tháng/ ít nhất 1 năm, cho phép phát hiện sớm sự phát triển của virus có thể dẫn đến mất bù
- XG còn bù và HBV-DNA cao (>2.000 U/mL) được điều trị theo các khuyến nghị cho viêm gan virus B mạn HBeAg (-) và HBeAg (+)
- Điều trị thuốc kháng virus không loại trừ được nguy cơ HCC, cần tiếp tục theo dõi HCC
91
VIÊM GAN B MẠN TRÊN XƠ GAN MẤT BÙ
XGMB HBsAg (+) được điều trị thuốc kháng virus vô thời hạn bất kể nồng độ HBV DNA, HBeAg hoặc ALT để giảm nguy cơ biến chứng do gan xấu đi (AASLD 2018)
- Entecavir và tenofovir là thuốc được khuyến cáo. TAF chưa được nghiên cứu trong XGMB, do đó hạn chế sử dụng TAF. TAF hoặc entecavir nên được xem xét ở bệnh nhân XGMB có rối loạn chức năng thận và/hoặc bệnh về xương
- Chống chỉ định Peg‐IFN ở XGMB do tính an toàn
- Cân nhắc ghép gan ở những người đủ điều kiện
- Theo dõi chặt chẽ để phát hiện tác dụng phụ của điều trị kháng virus: suy thận, nhiễm toan lactic
- Điều trị thuốc kháng virus không loại trừ được nguy cơ HCC, cần tiếp tục theo dõi HCC
92
Điều trị Viêm gan C (không hoặc có đồng nhiễm HIV) ở bệnh nhân xơ gan còn bù (Child-Pugh A) (EASL 2018)
HCV Điều trị trước SOF/VEL GLE/PIB SOF/VEL /VOX
SOF/LED GZR/EBR OBV/PIV/ r+DSV G1a Không 12 tuần 12 tuần không 12 tuần 12 tuần (≤8.105 IU/ml)
không G1a Có 12 tuần 12 tuần không không không G1b K/Có 12 tuần 12 tuần không 12 tuần 12 tuần 12 tuần G2 K/Có 12 tuần 12 tuần không không không không G3 K/Có không 12 tuần 12 tuần không không không G4 Không 12 tuần 12 tuần không 12 tuần 12 tuần (≤8.105 IU/ml) không G4 Có 12 tuần 12 tuần không không không không G5 Không 12 tuần 12 tuần không 12 tuần không không G5 Có 12 tuần 12 tuần không không không không G6 Không 12 tuần 12 tuần không 12 tuần không không G6 Có 12 tuần 12 tuần không không không không DSV: dasabuvir; EBR: elbasvir; GLE: glecaprevir; GZR: grazoprevir; LDV: ledipasvir; OBV: ombitasvir; PIB: pibrentasvir; PTV: paritaprevir; r: ritonavir; SOF: sofosbuvir; VEL: velpatasvir; VOX: voxilaprevir
93
94
KẾT LUẬN
Võ Thị Mỹ Dung [email protected] Bộ môn Nội tổng quát
XG là giai đoạn cuối của nhiều loại bệnh gan mạn
BN XGMB thường nhập viện & có nguy cơ cao bị tử vong do biến chứng
Điều trị lý tưởng ở giai đoạn mất bù là ngăn ngừa xơ gan tiến triển

 Clinical Infectious Diseases
Clinical Infectious Diseases



 Acute increase of ≥2 SOFA points (a proxy for organ dysfunction)
Acute increase of ≥2 SOFA points (a proxy for organ dysfunction)













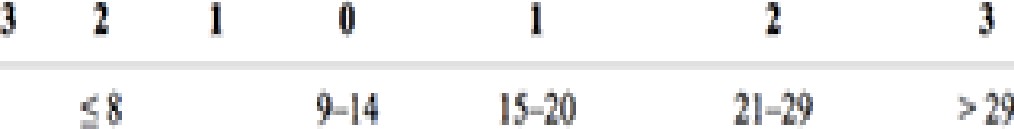


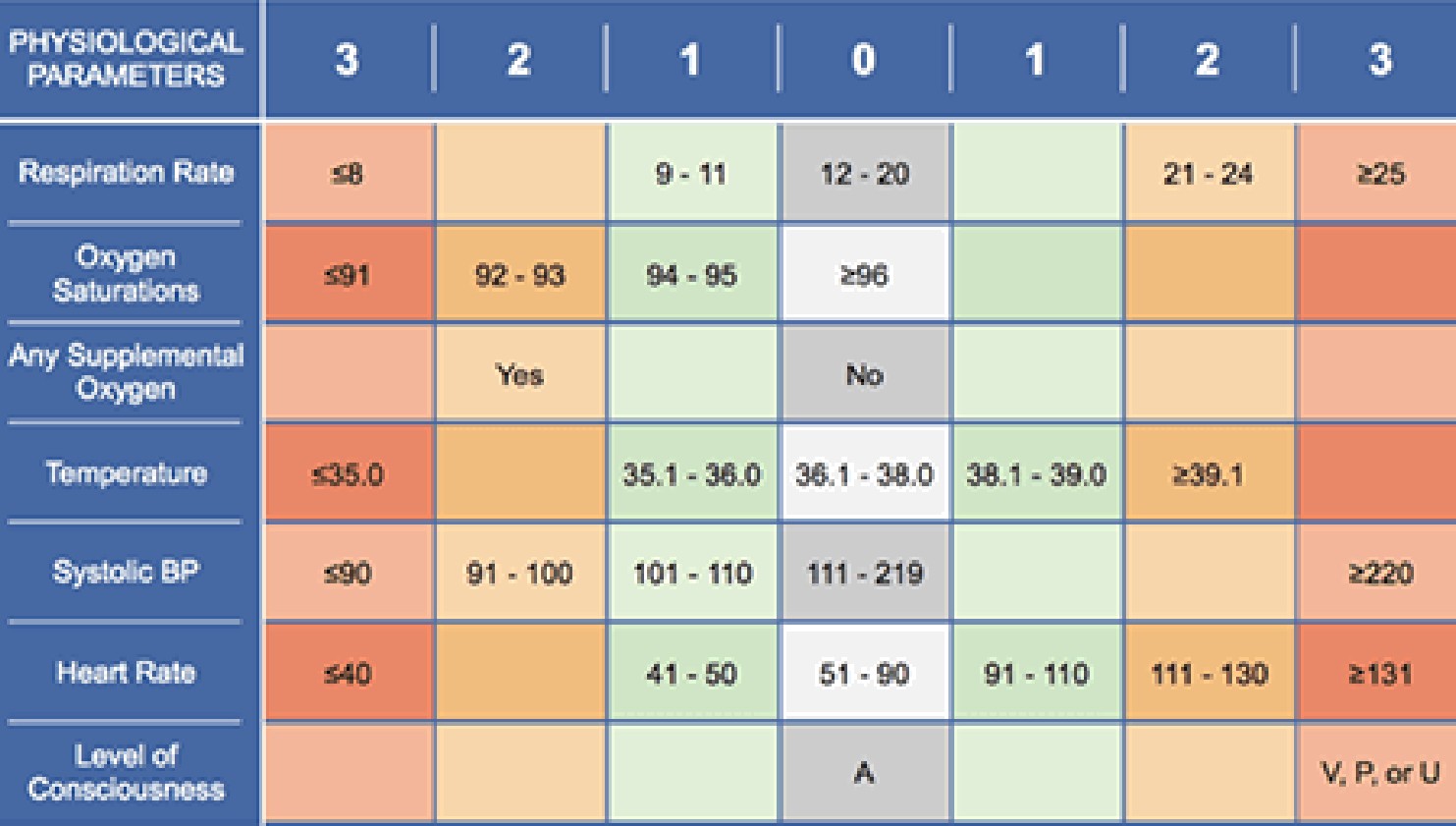
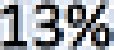





 Evaluated SF-36 physical function and mental health domains at 6 months
Evaluated SF-36 physical function and mental health domains at 6 months

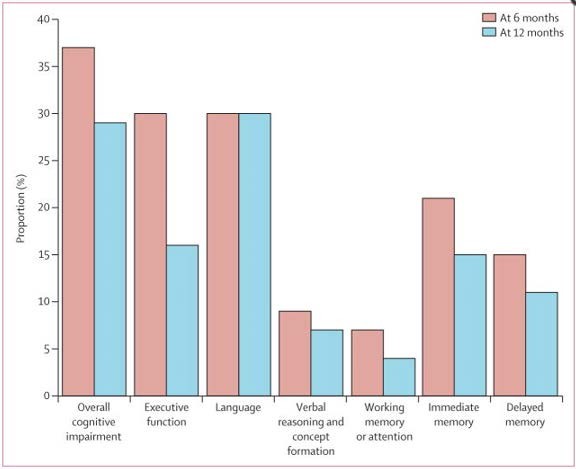 Evaluated impact of rosuvastatin on delirium
Evaluated impact of rosuvastatin on delirium







 If clinical examination dose not lead to clear diagnosis of volume status, use additional hemodynamic measures
If clinical examination dose not lead to clear diagnosis of volume status, use additional hemodynamic measures


 Use prone positioning for ARDS with PaO2/FIO2 ratio < 150 (previously 100)
Use prone positioning for ARDS with PaO2/FIO2 ratio < 150 (previously 100)
 Place post-pyloric feeding tubes for feeding intolerance or if high risk for aspiration
Place post-pyloric feeding tubes for feeding intolerance or if high risk for aspiration












 membrane
membrane

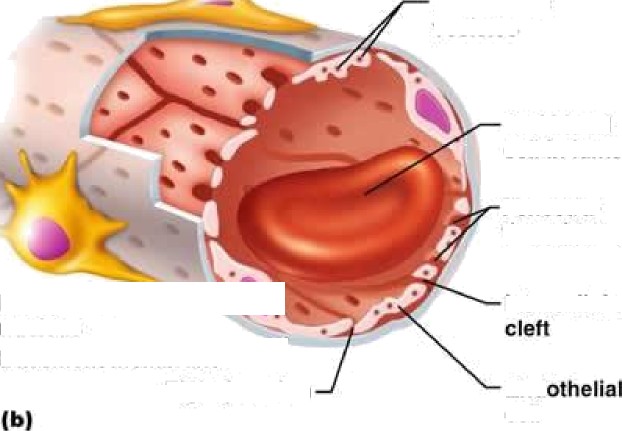
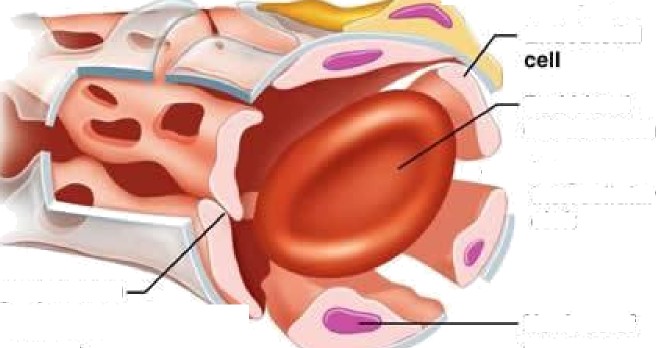






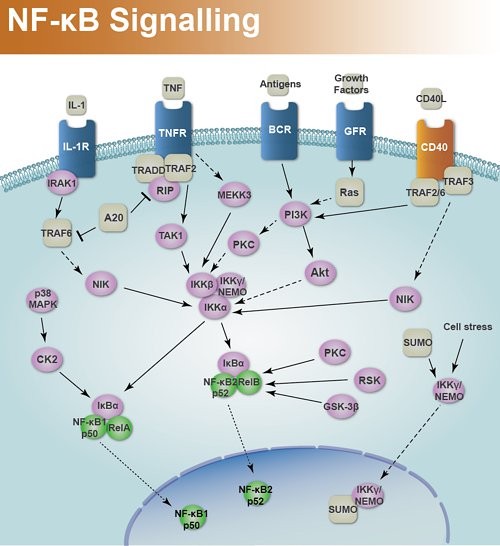


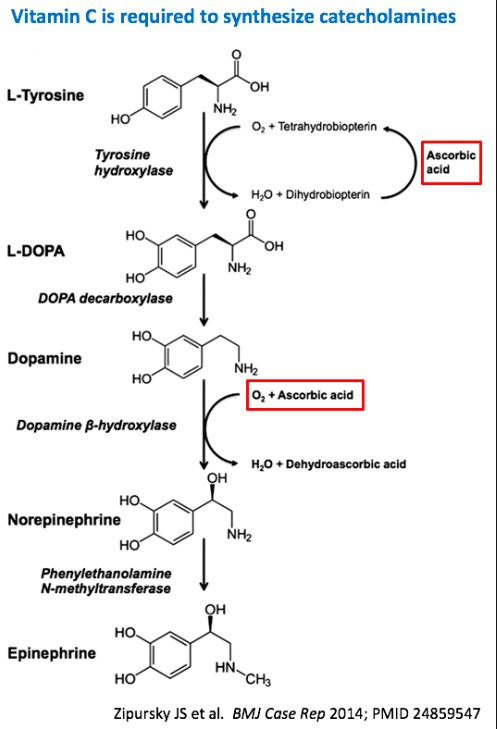 Vitamin C is required for catecholamine synthesis
Vitamin C is required for catecholamine synthesis


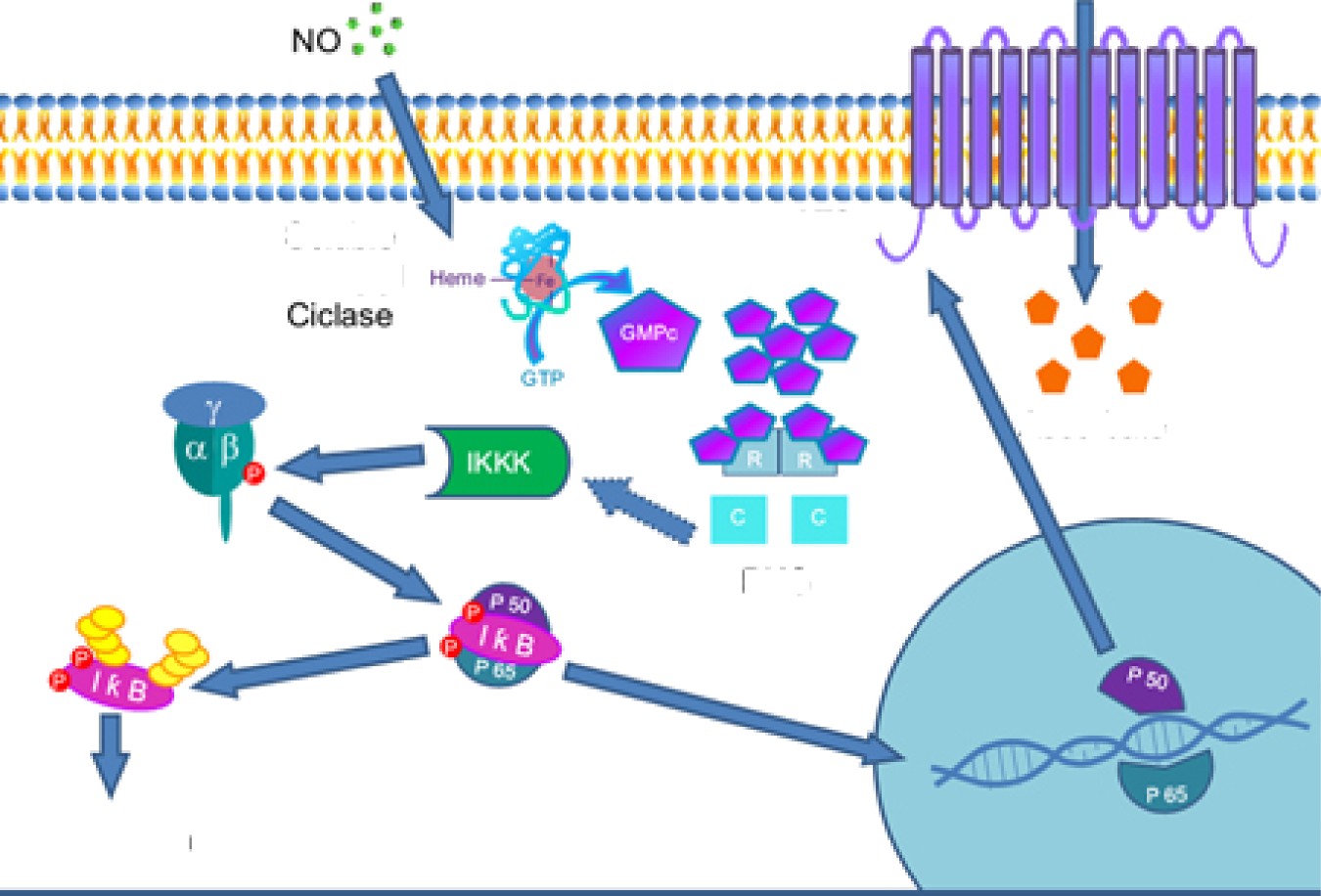

 Vitamin C alone: no help Steroids alone: no help
Vitamin C alone: no help Steroids alone: no help
 Shunts metabolism of vitamin C away from oxalate (potential for renal crystallization)
Shunts metabolism of vitamin C away from oxalate (potential for renal crystallization)

 Harms of omission
Harms of omission











 Nhiễm độc toàn thân
Nhiễm độc toàn thân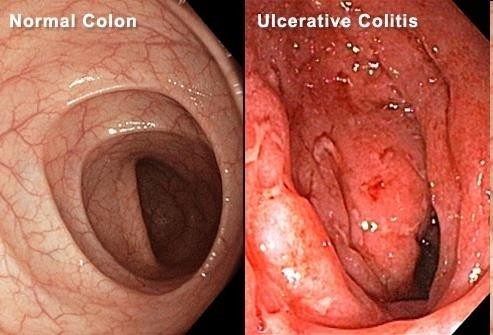
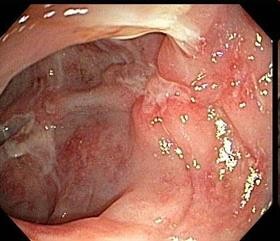
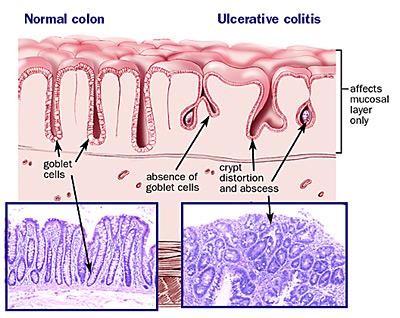
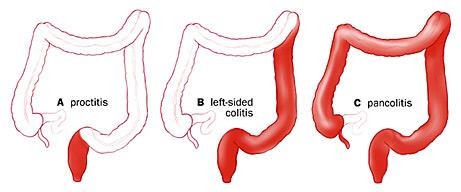
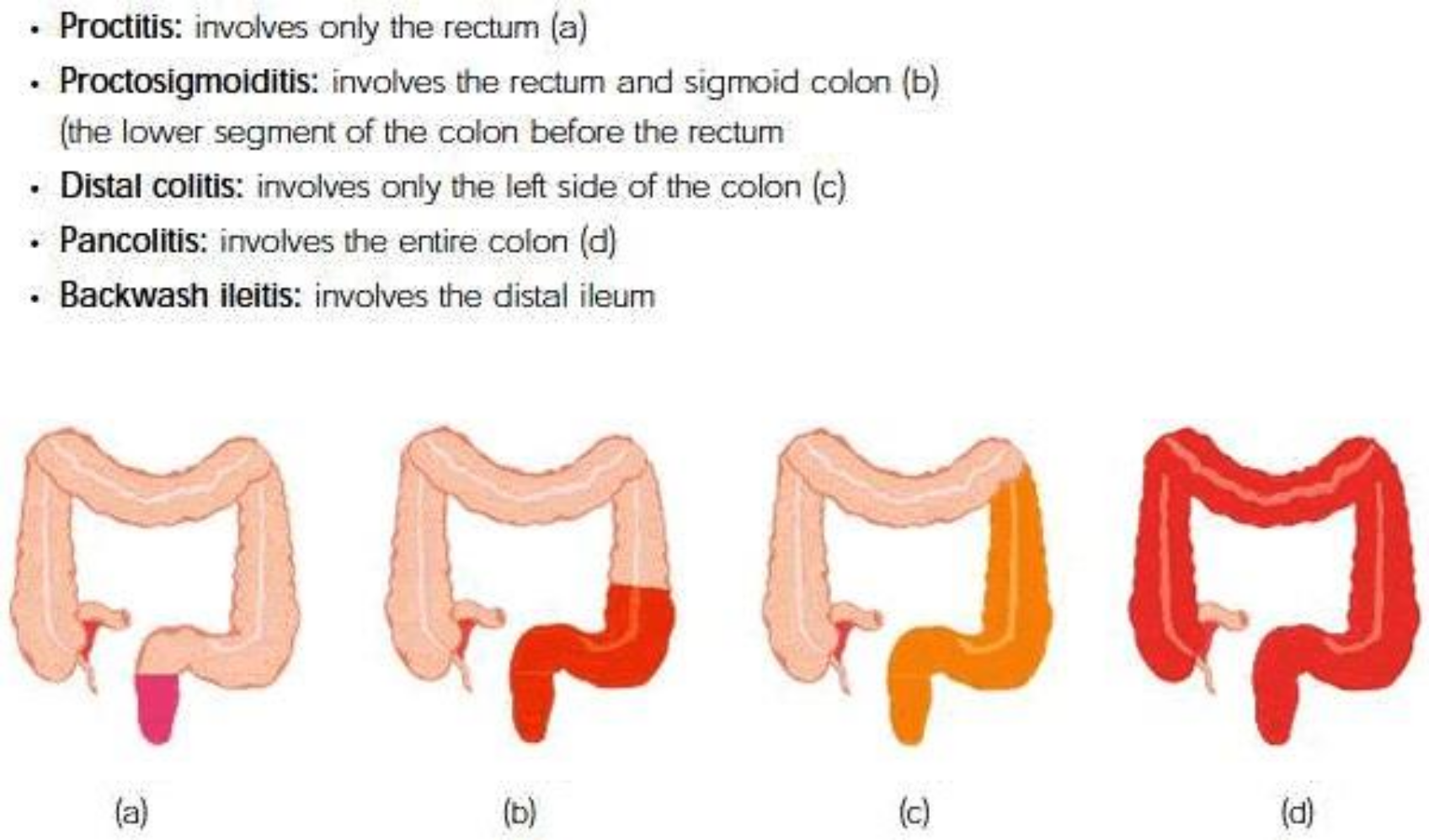



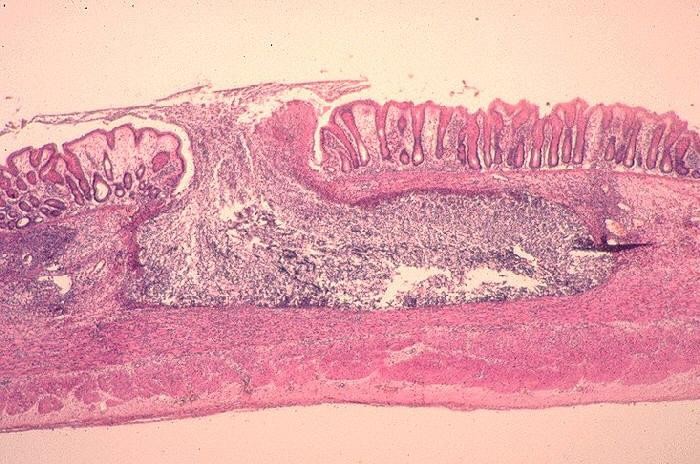
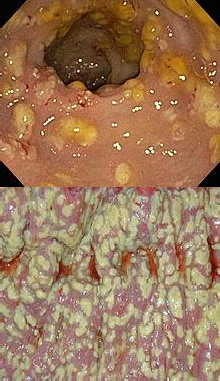

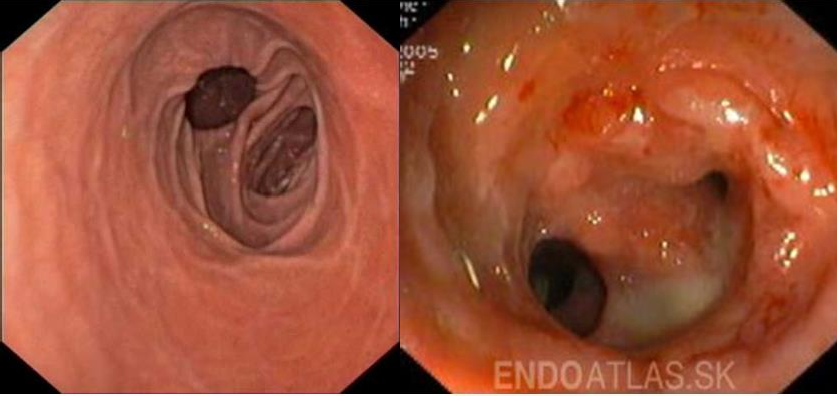

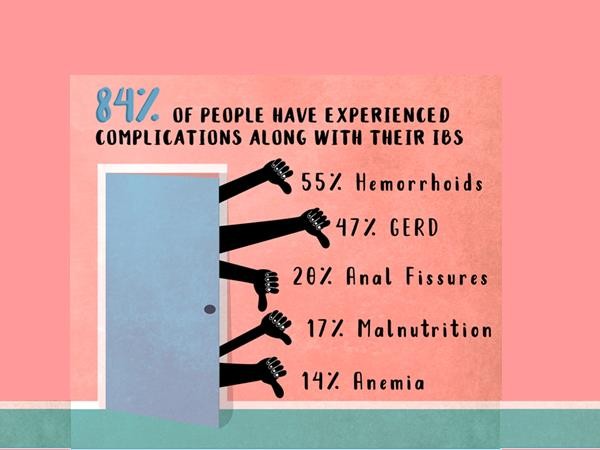

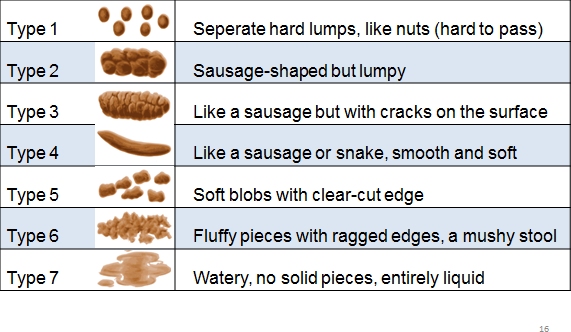









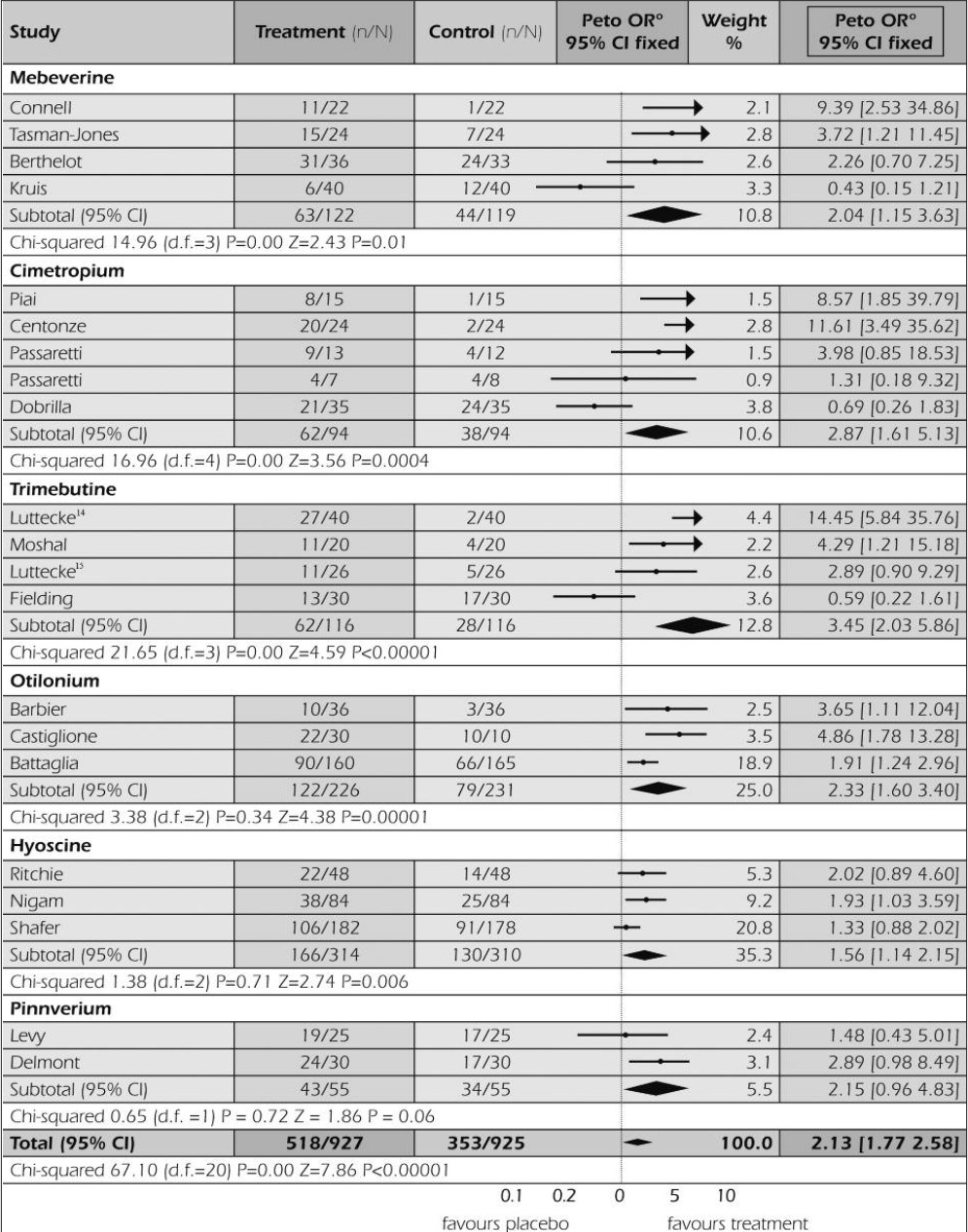

 LTT: loét HTT # 90% LTT, sau môn vị 1-3 cm thành trước, thành sau
LTT: loét HTT # 90% LTT, sau môn vị 1-3 cm thành trước, thành sau
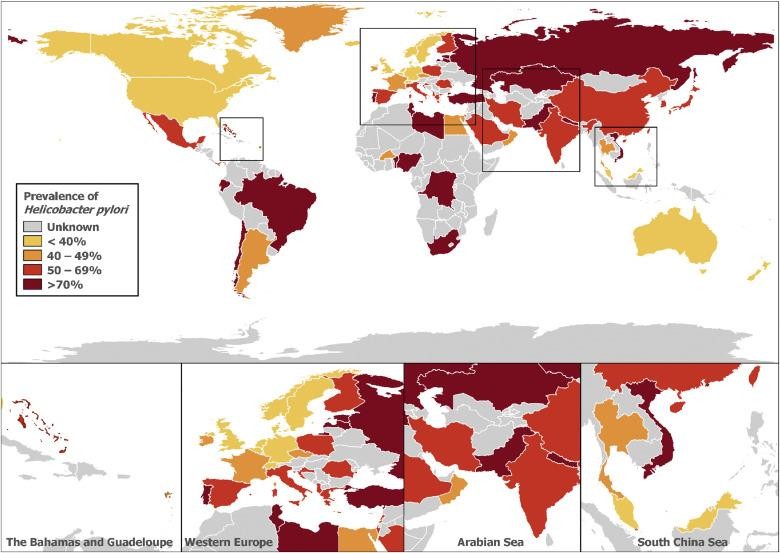
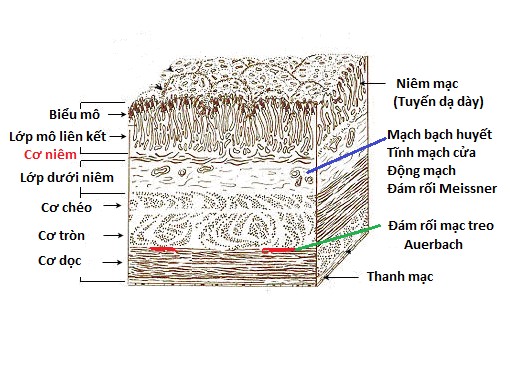
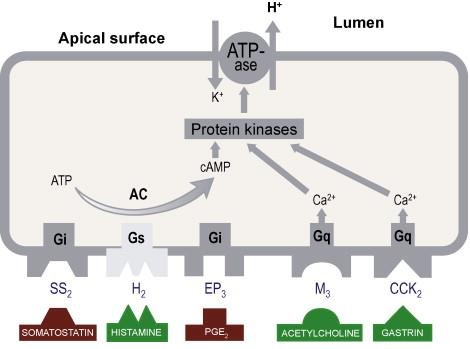
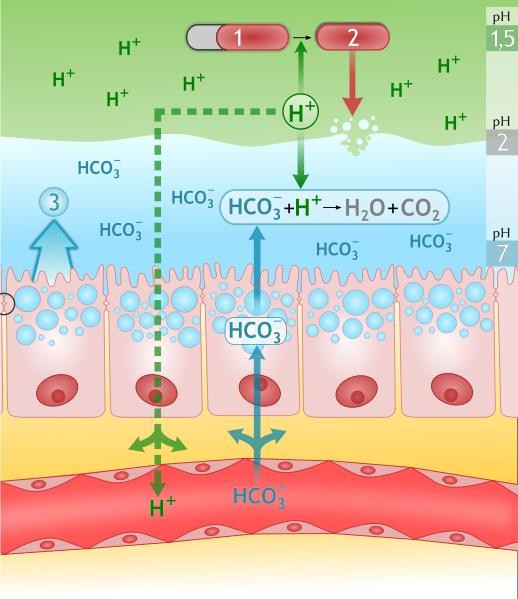


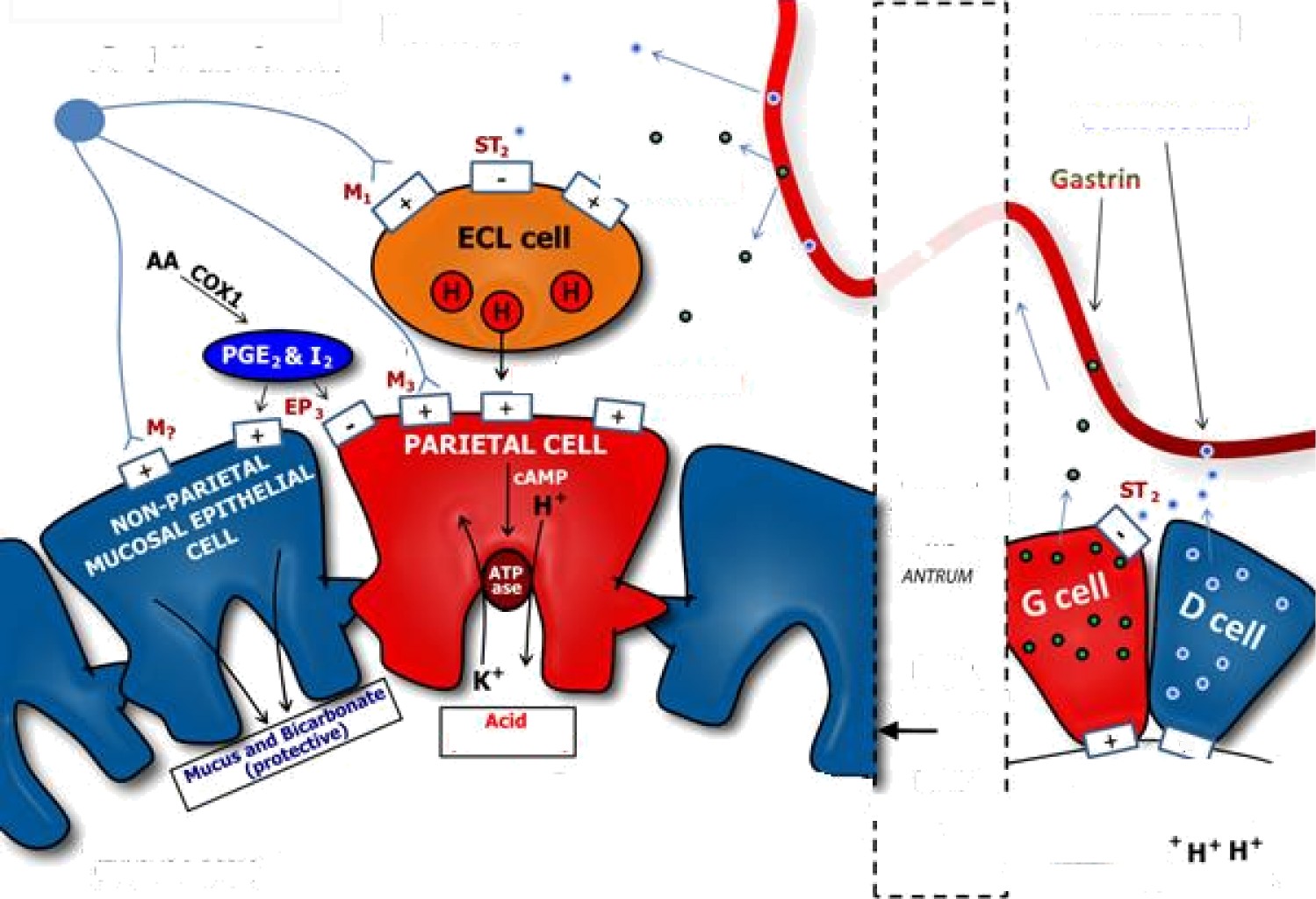


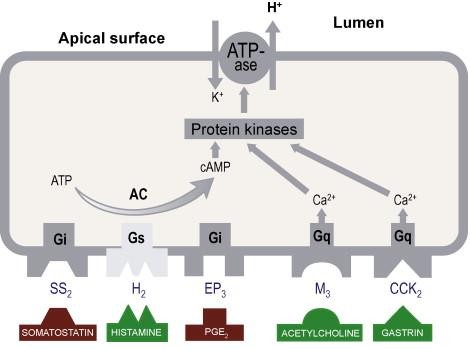

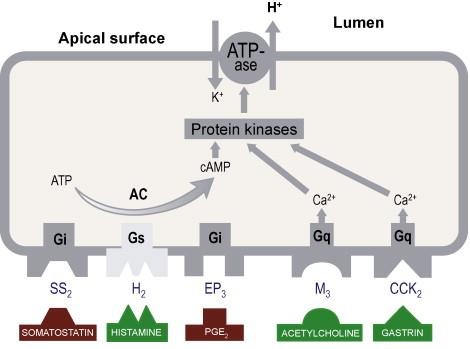
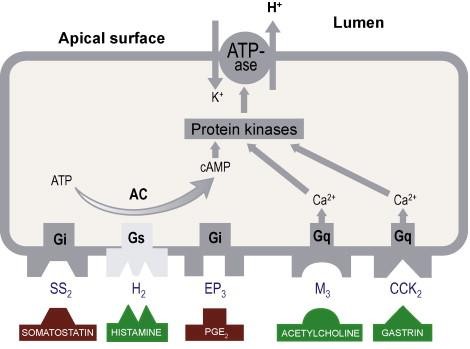
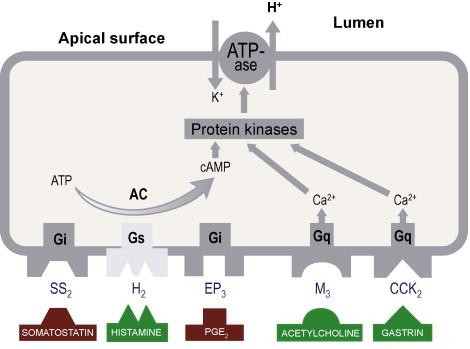
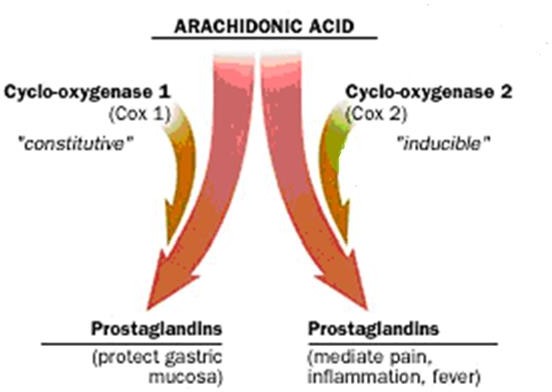
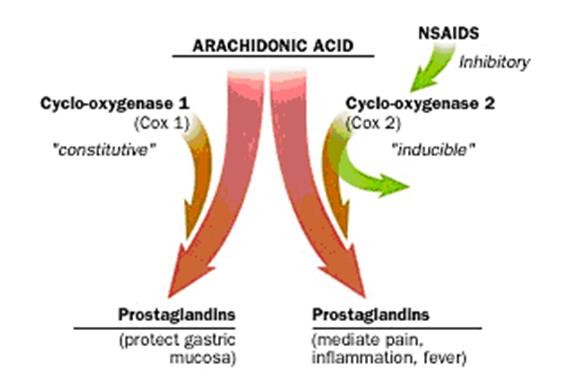
 Tỉ lệ tiệt trừ thành công <80%
Tỉ lệ tiệt trừ thành công <80% ngưng kháng sinh 4 tuần, PPI 2 tuần
ngưng kháng sinh 4 tuần, PPI 2 tuần
 PCR: định týp H.pylori
PCR: định týp H.pylori Tìm kháng nguyên trong phân
Tìm kháng nguyên trong phân
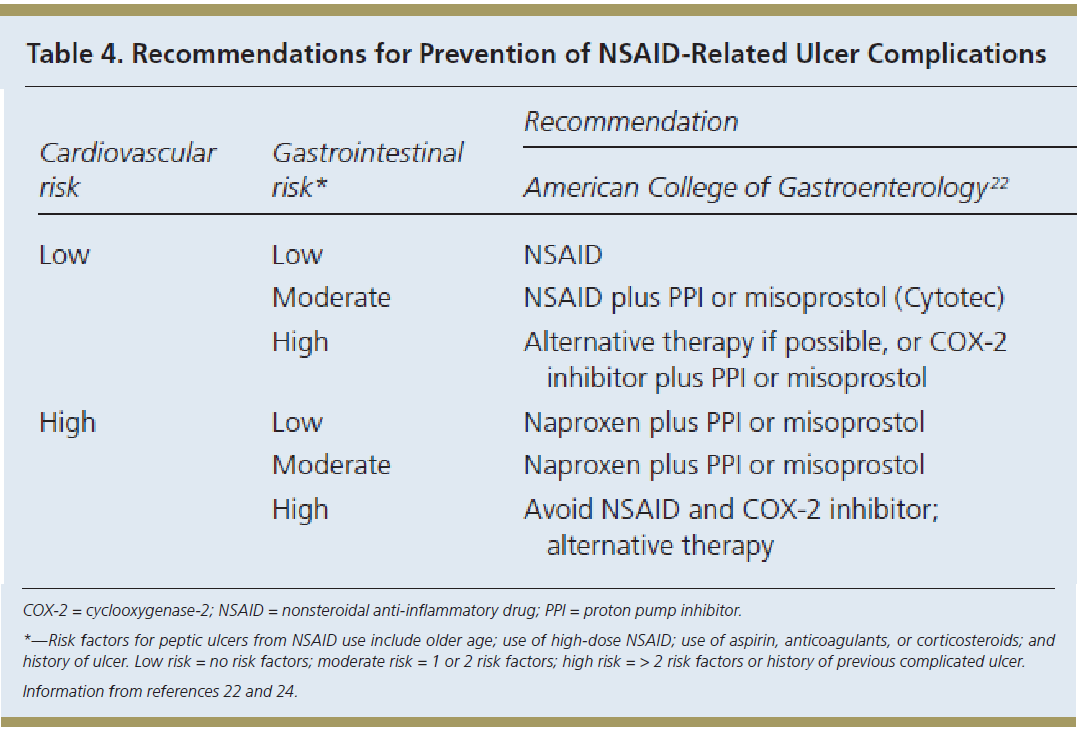



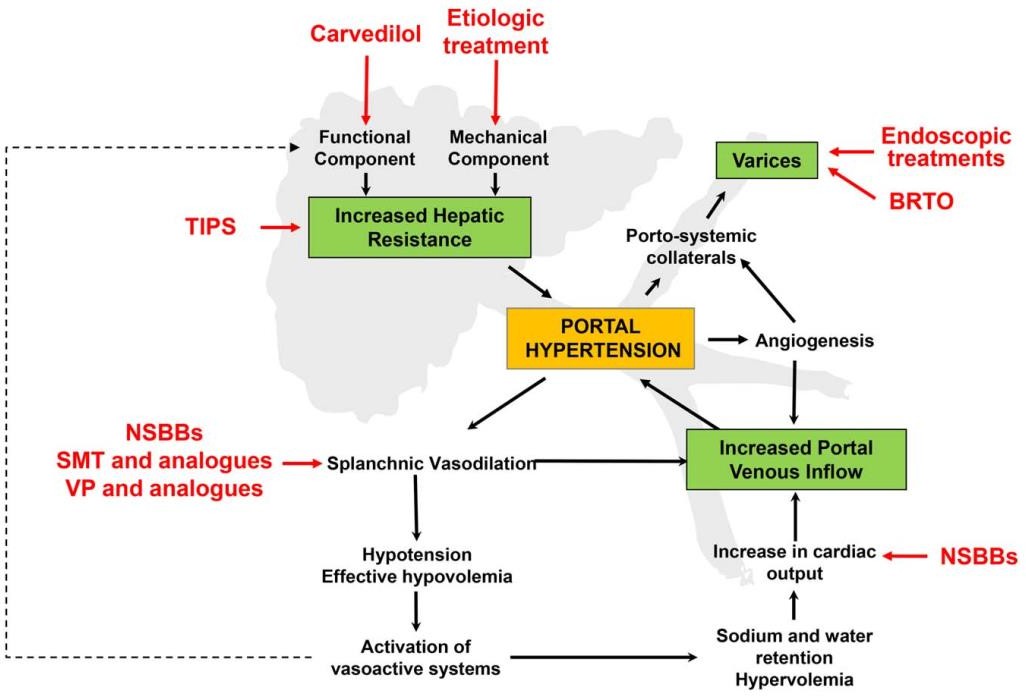 46
46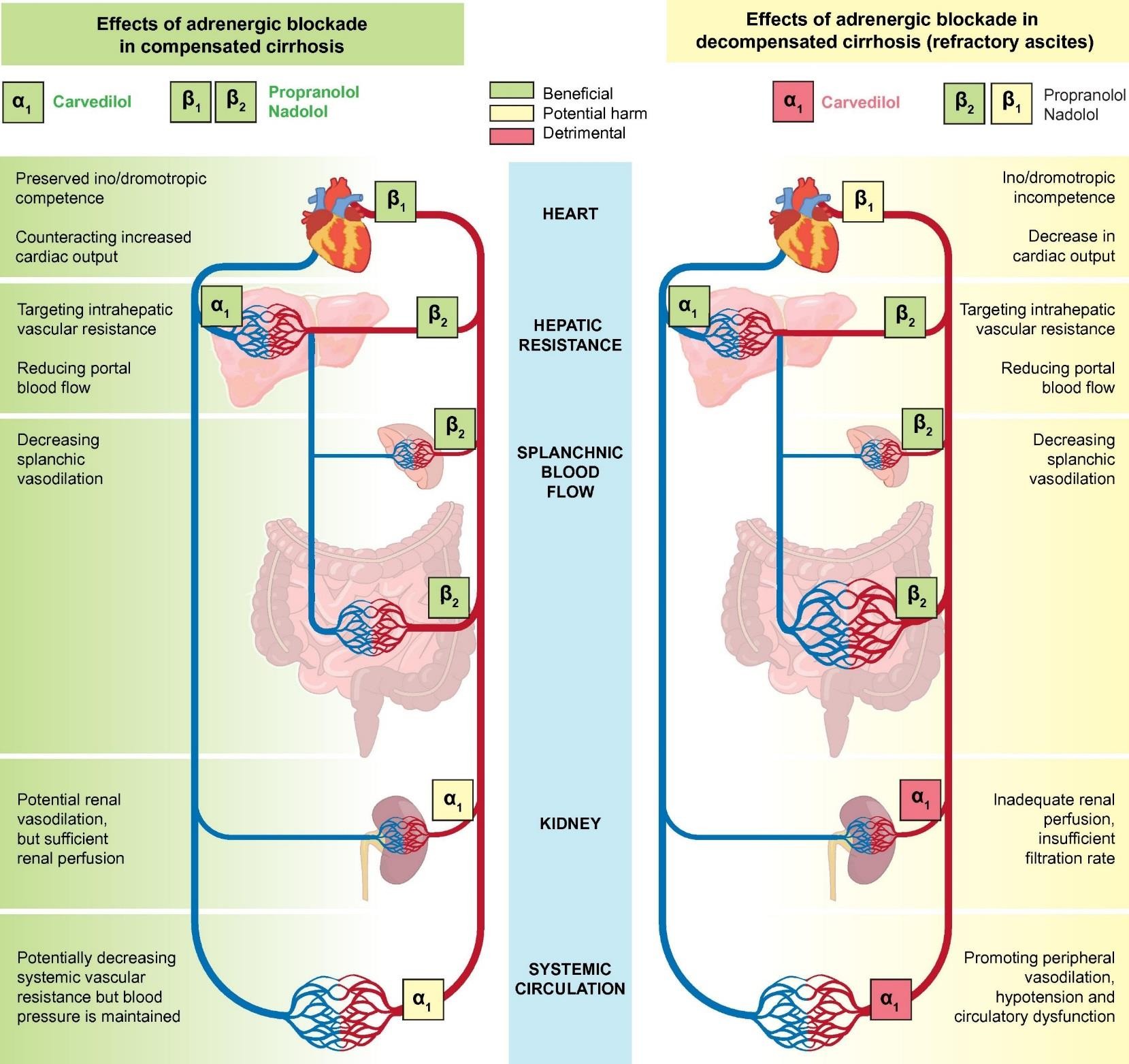
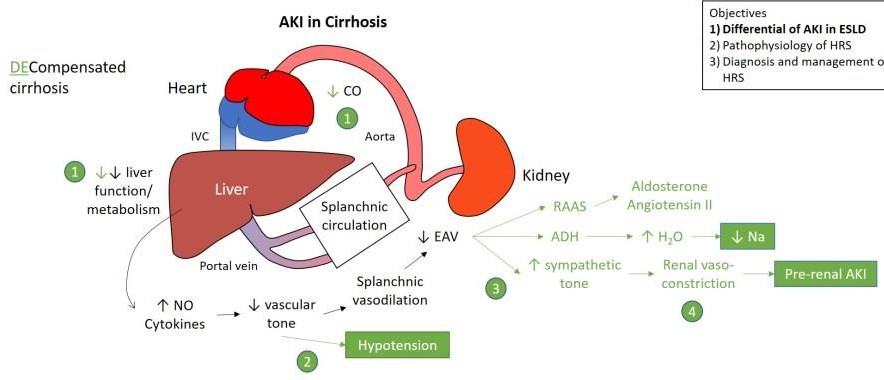
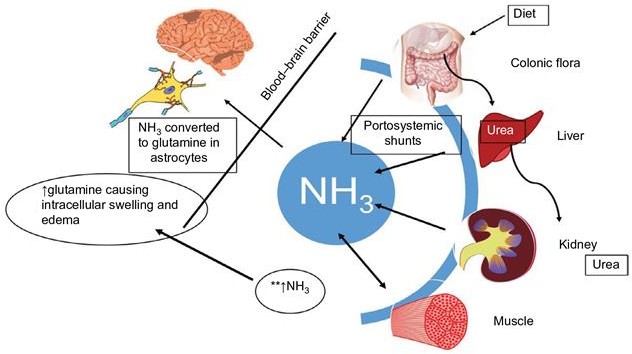










 cải thiện rõ tình trạng thần kinh & EEG
cải thiện rõ tình trạng thần kinh & EEG